Fosfori(III)oksidi (fosforitrioksidi, P4O6) - määritelmä, kaava ja ominaisuudet
Fosfori(III)oksidi (P4O6) — selkeä määritelmä, kemiallinen kaava (P2O3/P4O6), rakenne, hapetusaste +3 ja keskeiset fysikaalis‑kemialliset ominaisuudet.
Fosfori(III)oksidi, joka tunnetaan myös nimellä fosforitrioksidi, on kemiallinen yhdiste. Sen empiirinen kaava on P2O3, mutta molekyylikaavana yleisimmin käytetään P4O6. Fosforin hapetusaste tässä yhdisteessä on +3 (hapetusasteessa +3). Kyseessä ei ole ioniyhdiste vaan kovalenttinen molekyyli, joka koostuu fosfori- ja happiatomeista; alkuperäisessä tekstissä käytetty ilmaus "fosfori- ja oksidi-ioneja" on harhaanjohtava, koska P4O6:n sidokset ovat pääosin kovalenttisia.
Rakenne ja kaava
P4O6 on kuutiomainen/koppurainen häkki- eli 'cage' -molekyyli, joka voidaan ajatella syntyvän P4-tetraedrista, jossa jokainen P–P-sidos on korvattu P–O–P-sillalla. Tällöin kullakin fosforiatomilla on kolme sidosta happiatomeihin ja yksi vapaa elektroniparinsa, eli fosforiatomi on kolmiarvoinen (trigonaalinen pyramidi). Tämän vuoksi yhdiste kuvaa fosforin oksidia hapetusasteessa +3.
Fysikaaliset ominaisuudet
- Yleensä väritön tai valkoinen, kiteinen aine.
- Se on molekyylirakenteinen yhdiste (ei ioninen) ja käyttäytyy erilailla kuin suolat.
- Altistettuna ilmaan P4O6 hapettuu helposti fosfori(V)-oksidiksi (P4O10).
Kemialliset ominaisuudet ja reaktiot
P4O6 on fosforinhapettamisen välimuoto ja toimii kemiallisena lähtöaineena tai reaktiotuotteena useissa reaktioissa. Tärkein tunnusomainen reaktio on hydrolyysi, jossa P4O6 reagoi veden kanssa muodostaen fosforihapon (fosforihappo on tässä fosforihapon alempi oksidaani eli fosforinhappo H3PO3, tavallisesti nimellä fosforinhappo/fosfori‑III-happo):
P4O6 + 6 H2O → 4 H3PO3
P4O6 toimii myös pelkistimen monissa olosuhteissa ja se hapettuu helposti edelleen P4O10:ksi (fosfori(V)oksidi).
Valmistus
Fosfori(III)oksidia syntyy, kun valkoista fosforia poltetaan rajoitetussa määrässä happea tai kun fosforin osittaista palamista rajoitetuissa olosuhteissa pysäytetään ennen täydellistä hapettumista P4O10:ksi. Laboratoriossa se voidaan saada kontrolloiduissa olosuhteissa johtamalla fosforikaasuja ja rajoitettua happimäärää yhteen.
Käyttöalueet
- Teollisessa mittakaavassa P4O6:lla on rajallinen käyttö verrattuna fosfori(V)oksidiin (P4O10), mutta sitä voidaan hyödyntää orgaanisen synteesin välituotteena ja tutkimuskemikaalina.
- Sitä voidaan käyttää myös tiettyjen fosforiyhdisteiden valmistuksessa ja kemiallisissa muunnoksissa, joissa tarvitaan fosforin +3-olomuotoa.
Terveys ja turvallisuus
P4O6 on myrkyllistä ja ärsyttävää. Se reagoi veden kanssa muodostaen fosforihappoja, jotka voivat ärsyttää ihoa, silmiä ja hengitysteitä. Aineen käsittelyssä tulee käyttää suojavarusteita (hanskat, suojalasit, suojavaatteet) ja työskennellä imuputkessa/kaapissa. Palovaaran vuoksi tulee välttää valkoisen fosforin käsittelyä ilman asianmukaista varovaisuutta; P4O6 itsessään hapettuu helposti ilmakehässä ja voi muodostaa korrosoivia tuotteita.
Vertailu fosfori(V)oksidiin
P4O6 eroaa fosfori(V)oksidista P4O10 kemiallisesti siten, että P4O6 vastaa fosforin alempaa hapetusastetta (+3) kun taas P4O10 on fosforin korkeimmassa yleisessä hapetusasteessa (+5). P4O10 on voimakas desikaantti (kuivausaine) ja laajemmin käytetty teollisesti, kun taas P4O6 on reaktiivisempi suhteessa hydrolyysiin ja pelkistysominaisuuksiin.
Yhteenvetona: Fosfori(III)oksidi (fosforitrioksidi, P4O6) on kovalenttinen, molekyylirakenteinen fosforin oksidi, jonka fosfori on hapetusasteessa +3. Se toimii anhydridina fosforihapolle H3PO3, hydrolysoituu helposti ja on kemiallisesti reaktiivinen, joten sen käsittely vaatii varovaisuutta.
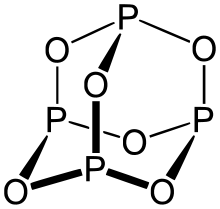
Fosforitrioksidin rakenne
Ominaisuudet
Se on valkoinen, vahamainen kiinteä aine, joka voi imeä itseensä vettä. Se reagoi veden kanssa muodostaen fosforihappoa. Se reagoi suolahapon kanssa muodostaen fosforitrikloridia ja fosforihappoa. Se on pelkistävä aine. Se on myrkyllistä ja sen haju muistuttaa valkosipulin hajua.
Valmistelu
Sitä valmistetaan polttamalla fosforia pienessä määrässä ilmaa. Tämä on monien fosforiyhdisteiden lähde.
Käyttää
Se voi kiinnittyä tiettyihin siirtymämetalleihin.
Aiheeseen liittyvät sivut
- Fosfori(V)oksidi
- Fosfaatti
- Fosfiitti
Etsiä