Vedyn isotoopit – protium, deuterium ja tritium: määritelmä ja ominaisuudet
Tutustu vedyn isotooppeihin — protium, deuterium ja tritium: määritelmät, ominaisuudet, stabiilisuus ja radioaktiivisuus selkeästi ja tiiviisti.
Vedyllä on kolme pääisotooppia: protium (1H), deuterium (2H) ja tritium (3H). Nämä isotoopit muodostuvat luonnossa. Protium on yleisin ja koostuu yhdestä protonista ilman neutronia. Deuterium sisältää yhden neutronin, ja se on stabiili. Tritium on radioaktiivinen ja hajoaa beetahajoamisella helium-3:ksi; sen puoliintumisaika on noin 12,32 vuotta. Tutkijat ovat lisäksi luoneet laboratorio-oloissa lyhytikäisiä vedyn isotooppeja, kuten 4H–7H, mutta ne ovat erittäin epävakaita eikä niitä esiinny merkittävästi luonnossa.
Määritelmä ja perusominaisuudet
Isotoopit ovat saman alkuaineen atomeja, joilla on sama määrä protoneja mutta eri määrä neutroneja. Vedyn tapauksessa protonien määrä on aina yksi, joten isotooppien ero tulee neutroneista. Tästä johtuen vedyllä on poikkeuksellisen yksinkertaiset ja helposti tunnistettavat isotoopit:
- Protium (1H): yksi protoni, ei neutronia. Suurin osa vedystä on tätä isotooppia.
- Deuterium (2H, myös D): yksi protoni ja yksi neutroni. Stabiili, suhteellisen harvinainen luonnossa mutta helposti erotettavissa ja hyödyllinen monissa sovelluksissa.
- Tritium (3H, myös T): yksi protoni ja kaksi neutronia. Radioaktiivinen ja harvinainen luonnossa; syntyy esimerkiksi kosmisten säteiden vaikutuksesta ilmakehässä ja ydinreaktoreissa.
Luonnollinen esiintyminen ja runsaus
Protium muodostaa lähes kaiken luonnollisen vedyn: sen osuudet luonnollisessa vedessä ovat noin 99,98 %. Deuteriumin luonnollinen runsaus on noin 0,0156 % (noin 156 ppm), mikä riittää esimerkiksi raskaan veden (D2O) valmistukseen teollisesti erotusmenetelmillä kuten elektrolyysillä, kemiallisilla vaihtoprosesseilla tai fraktioimisella. Tritiumia esiintyy luonnossa vain hyvin pieniä määriä, mutta sitä syntyy myös ihmisen toiminnan seurauksena ydinreaktoreissa ja ydinasekokeissa.
Fysikaaliset ja kemialliset erot
Deuteriumin ja protiumin välillä on merkittävä massiero: deuteriumin atomin massa on noin kaksinkertainen verrattuna protiumiin, ja tritium on vielä raskaampi. Tämä johtaa useisiin havaittaviin eroihin:
- Fysikaaliset ominaisuudet: D2O:n sulamis- ja kiehumispisteet ovat hieman korkeammat kuin H2O:n; esimerkiksi raskaan veden tiheys on suurempi. Massan erot vaikuttavat myös esimerkiksi lämpökapasiteettiin ja diffuusiokertoimiin.
- Kemialliset reaktiot ja isotooppiefekti: Kevyemmän ja raskaamman vedyn väliset massat vaikuttavat reaktioiden nopeuksiin (kineettinen isotooppiefekti). Tämä tarkoittaa, että kemiallisissa reaktioissa, joissa vedyn sidokset katkeavat tai muodostuvat, deuteriumin sisältämät molekyylit reagoivat usein hitaammin kuin protiumia sisältävät.
- Radioaktiivisuus: Tritium tuottaa matalaenergistä beetasäteilyä, joka ei läpäise ihoa syvälle, mutta tritium on vaarallisin, jos sitä pääsee elimistöön hengityksen, ruuan tai veden mukana.
Käyttö ja sovellukset
Vedyn isotoopeilla on monia tärkeitä sovelluksia:
- Deuterium (D): käytetään raskaan veden muodossa neutronien hidastimena joissakin ydinreaktoreissa (esim. CANDU), ja deuteriumia käytetään myös isotooppileimauksessa, NMR-spektroskopiassa (D2O-liuos kantajana) sekä tutkimuksissa, joissa halutaan seurata veden liikettä tai reaktiomekanismeja.
- Tritium (T): käytetään joskus valoa tuottavissa laitteissa (esim. tritium-valomerkit), ydinfuusion polttoaineena kokeellisissa laitteissa (yhdessä deuteriumin kanssa), sekä tutkimukseen käytettävänä radioisotooppina ja seurantamerkkinä hydrologiassa ja ympäristötutkimuksissa. Tritiumin radioaktiivisuus tekee siitä käyttökelpoisen merkkiaineen, mutta sama ominaisuus aiheuttaa turvallisuus- ja hävittämishaasteita.
- Isotooppileimaukset: Deuteriumia ja tritiumia käytetään laajasti biokemiallisissa ja lääketieteellisissä merkintätutkimuksissa seurantamolekyyleinä.
Tuotanto ja erotus
Deuterium erotetaan luonnollisesta vedestä useilla menetelmillä, kuten elektrolyysillä, fraktioivalla tislauksella ja kemiallisella vaihtotekniikalla. Tritiumia tuotetaan pääasiassa ydinreaktoreissa neutronisäteilyn vaikutuksesta litium- tai booriyhdisteissä, tai se syntyy myös kosmisten säteiden aiheuttamina reaktioina ilmakehässä.
Turvallisuus ja ympäristö
Tritiumin radioaktiivisuus vaatii erityistä käsittelyä: vaikka sen beetasäteily on matalaenergiaista, sisäinen altistus (hengitys, nieleminen) voi aiheuttaa säteilyannoksen kudoksille. Tritiumia sisältävät jätteet täytyy käsitellä ja varastoida asianmukaisesti. Deuterium ja protium ovat kemiallisesti turvallisia normaaleissa olosuhteissa; raskaan veden pitkäaikainen käyttö voi kuitenkin vaikuttaa biologisiin prosesseihin, jos se korvaa merkittävästi normaalia vettä eliöiden elimistössä.
Nimet ja tunnukset
Vedyn pääisotoopit ovat poikkeuksellisia myös nimien puolesta: ne ovat ainoat isotoopit, joilla on vakiintuneet nimet (protium, deuterium, tritium). Deuteriumia ja tritiumia merkitään usein lyhenteillä D ja T. Kansainvälinen puhtaan ja soveltavan kemian liitto suhtautuu näihin nimityksiin varauksellisesti, mutta käytännössä D- ja T-merkinnät ovat laajasti käytössä tieteessä ja tekniikassa.
Yhteenvetona: vedyllä on yksinkertaiset mutta biologisesti ja teknisesti merkitykselliset isotoopit. Protium on yleisin ja kemiallisesti perusedullinen, deuterium tarjoaa mahdollisuuden tutkimukseen ja teollisiin sovelluksiin raskaan veden muodossa, ja tritium on tärkeä radioaktiivinen merkkiaine ja fuusiopolttoaineen komponentti, jonka käsittely vaatii huolellisuutta.
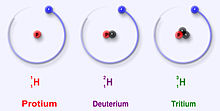
Vedyn kolme stabiilimpaa isotooppia
Protium (vety-1)
Protium on vedyn yleisin isotooppi. Se muodostaa yli 99,98 prosenttia kaikesta maailmankaikkeuden vedystä. Se on nimetty protiumiksi, koska sen ytimessä on vain yksi protoni. Protiumin atomimassa on 1,00782504(7) u. Protiumin tunnus on 1H.Protiumin protoni ei ole koskaan hajonnut havainnossa, joten tutkijat uskovat, että protium on vakaa isotooppi. Uudet hiukkasfysiikan teoriat ennustavat, että protoni voi hajota, mutta tämä hajoaminen on hyvin hidasta. Protonin puoliintumisajan sanotaan olevan 1036 vuotta. Jos protonin hajoaminen on totta, kaikki muut ytimet, joiden sanotaan olevan vakaita, ovat itse asiassa vain havaintojen mukaan vakaita, eli ne näyttävät olevan vakaita. Viimeaikaiset kokeet ovat osoittaneet, että jos protonin hajoaminen todella tapahtuu, sen puoliintumisaika on 6,6 × 1033 vuotta.
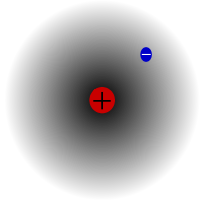
Protium, vedyn yleisin isotooppi. Se on erityinen, koska se on ainoa isotooppi, jossa ei ole neutronia.
Deuterium (vety-2)
Deuterium eli 2H tai joskus D on toinen vedyn stabiili isotooppi. Isotoopissa on yksi protoni ja yksi neutroni. Se muodostaa noin 0,0026-0,0184 prosenttia kaikista maapallon vetyatomeista. Deuteriumia on vähemmän vetykaasussa maapallolla ja enemmän merivedessä (0,015 % tai 150 ppm). Deuterium ei ole radioaktiivinen, eikä se vahingoita eläviä olentoja. Deuterium voi myös muodostaa vesimolekyylejä. Vettä, jossa on protiumin sijasta deuteriumia, kutsutaan raskaaksi vedeksi.
Tritium (vety-3)
Tritium (3H) on vedyn stabiilein radioisotooppi. Toisin sanoen kaikista vedyn radioaktiivisista isotoopeista tritium on vähiten radioaktiivinen. Sen ytimessä on yksi protoni ja 2 neutronia. Tritium hajoaa beetaminushajoamisen kautta ja muuttuu helium-3:ksi. Sen puoliintumisaika on 12,32 vuotta.Tritiumia muodostuu luonnollisesti yläilmakehän kaasujen ja kosmisten säteiden vuorovaikutuksessa. Sitä syntyy myös ydinasekokeissa. Tritiumia ja deuteriumia käytetään D-T-ydinfuusiossa tähdissä, jolloin syntyy paljon energiaa.
Kysymyksiä ja vastauksia
K: Kuinka monta vedyn pääisotooppia on olemassa?
V: Vedyn pääisotooppeja on kolme: protium, deuterium ja tritium.
K: Ovatko protium ja deuterium vakaita isotooppeja?
V: Kyllä, protium ja deuterium ovat vakaita isotooppeja.
K: Mikä on tritiumin puoliintumisaika?
V: Tritium on radioaktiivinen, ja sen puoliintumisaika on noin 12 vuotta.
K: Kuinka monta muuta vedyn isotooppia tutkijat ovat luoneet?
V: Tutkijat ovat luoneet neljä muuta vedyn isotooppia: 4H-7H.
K: Onko näitä neljää muuta vedyn isotooppia olemassa luonnossa?
V: Ei, nämä isotoopit ovat hyvin epävakaita, eikä niitä esiinny luonnossa.
K: Mikä tekee vedyn pääisotoopeista ainutlaatuisia?
V: Vedyn pääisotoopit ovat ainutlaatuisia, koska ne ovat ainoat isotoopit, joilla on nimi.
K: Onko deuteriumilla ja tritiumilla omat symbolinsa?
V: Kyllä, deuterium ja tritium saavat joskus omat symbolinsa: D ja T. Kansainvälinen puhtaan ja sovelletun kemian liitto ei kuitenkaan pidä näistä nimistä kovinkaan paljon, vaikka niitä käytetäänkin usein.
Etsiä