UV–vis-absorptio: määritelmä ja UV–vis-spektroskopian perusteet
UV–vis-absorptio: selkeä määritelmä ja perusteet UV–vis-spektroskopiasta — elektronisiirtymät, mittaukset ja sovellukset laboratorioon ja analytiikkaan.
UV-näkyvä absorptio on prosessi, jossa molekyyli absorboi ultravioletti- tai näkyvää valoa, joka herättää elektroneja (tekee niistä korkeaenergisiä). Tämä energia aiheuttaa elektronisen siirtymän perustilasta (ei-kiihottuneesta) kiihottuneeseen tilaan.
Tätä käytetään absorptiospektroskopian tekniikassa, joka tunnetaan nimellä UV-näköspektroskopia. UV–vis-spektroskopia on yleinen ja nopea menetelmä orgaanisten ja epäorgaanisten yhdisteiden rakenteen ja pitoisuuden tutkimukseen.
Miten UV–vis-absorptio toimii
Kun aineeseen osuu monocromattista tai kapea-alaisesti valon aallonpituutta, osa säteilystä absorboituu. Absorptio näkyy spektreissä piikkinä tai huippuna, jonka sijainti (aaltoleveys) ja intensiteetti kertovat näytteen elektronisista rakenteista. Usein analysoidaan absorptiota aallonpituusalueella noin 200–800 nm.
Elektronisiirtymät
Erilaiset elektronisiirtymät tuottavat eri tyyppisiä absorptioita. Yleisimmät ovat:
- π → π*: esiintyy yleensä konjugoiduissa kaksoissidoksissa ja aromaatissa järjestelmässä; aiheuttaa voimakkaita huippuja usein UV-alueella.
- n → π*: tapahtuu vapaista elektronipareista (esim. happi, typpi) konjugoituneisiin järjestelmiin; huiput ovat usein heikompia ja siirtyvät eri aallonpituuksille.
- Metallikomplekseissa ja epäorgaanisissa yhdisteissä esiintyy myös d–d- ja ligandista-metallille siirtymätyyppisiä absorptioita.
UV–vis-spektrometrin pääkomponentit
- Valonlähde: yleisesti deuteriumlamppu UV-alueelle ja halogeenilamppu näkyvälle alueelle.
- Monokromaatio: prisma tai verkkograting erottaa halutun aallonpituuden.
- Näyteastia: usein kvartsi- tai lasicuvetit; kvartsi on läpinäkyvä myös lyhyemmillä UV-aallonpituuksilla.
- Detektori: havaitsee läpäisseen valon määrän (esim. fotodiodi, PMT).
Beer–Lambertin laki ja kvantitatiivinen analyysi
UV–vis-menetelmä soveltuu myös pitoisuuden määritykseen Beer–Lambertin lain perusteella. Laki ilmaistaan usein muodossa A = ε · l · c, missä
- A = absorbanssi (mittayksikötonta),
- ε = molaarinen absorptiivisuus (M⁻¹ cm⁻¹),
- l = kennon paksuus (cm),
- c = analyytin konsentraatio (M).
Lakia käytetään suoraan kalibroimalla tunnetuilla pitoisuuksilla tai laskemalla konsentraatio tunnetun ε-arvon avulla. On huomattava, että laki pätee vain ideaalitapauksissa — korkeat konsentraatiot, kemialliset vuorovaikutukset tai hajaantuminen voivat aiheuttaa poikkeamia.
Näytevalmistelu ja liuotinvaikutus
Valitse liuotin, joka ei itse absorboi tutkittavalla aallonpituudella tai jonka vaikutus tunnetaan. Liuottimen polariteetti ja mahdollinen protolyysi voivat siirtää huippujen sijaintia (solvatochrome-vaikutus). Pitoisuus kannattaa mitoittaa niin, että absorbanssi jää lineaariselle alueelle (yleensä 0,1–1,0 A).
Sovelluksia
- Laadullinen analyysi: kromaforeiden tunnistus ja konjugaation aste.
- Kvantitatiivinen analyysi: pitoisuuksien määritys elintarvike-, ympäristö- ja lääkeaineanalyyseissa.
- Reaktionmonitorointi: reaktion edistymisen seuranta reaaliajassa.
- Biomolekyylien tutkimus: proteiinien, DNA:n ja pigmenttien absorptiomittaukset.
Vinkkejä käytännön mittauksiin
- Pidä käytössäsi puhdas nollaliuotinmittaus (blank), jolla kompensoidaan liuottimen ja kennon vaikutus.
- Vältä kuplia cuvetissa — ne häiritsevät mittausta.
- Merkitse selkeästi käytettynä aallonpituus ja kennon paksuus mittaustulosten toistettavuuden varmistamiseksi.
UV–vis-absorptio tarjoaa yksinkertaisen ja tehokkaan tavan tutkia molekyylien elektronirakennetta ja mitata niiden pitoisuuksia. Tuntemalla siirtymätyypit, instrumentin periaatteet ja mittauksen rajoitukset saat luotettavia ja tulkittavia spektrejä.
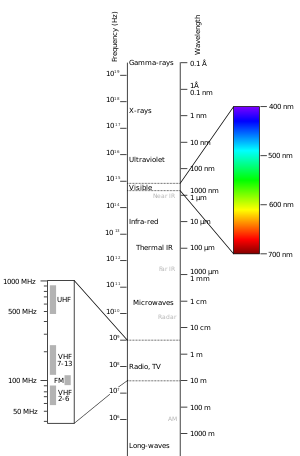
Sähkömagneettinen spektri
Energian absorptio
Eri molekyylit absorboivat valon eri aallonpituuksia. UV-säteilyn absorptiossa käytettävät valon aallonpituudet ovat noin 200 nanometristä 800 nanometriin. Tämä on kuvassa näkyvä sähkömagneettisen spektrin osa.
Valon absorptio alkaa, kun molekyyliin kohdistuu tietyn aallonpituuden energiaa UV-säteilyalueella. Valo/energia herättää sitten perustilassa olevat (ei-herätetyt) ulko- tai valenssielektronit herätettyyn tilaan (korkea energia). Tämän tulosta voidaan mitata UV-viisumispektrofotometrillä. Tiedot esitetään spektrinä, jossa absorptio on riippuvainen aallonpituudesta. Tätä kuviota voidaan käyttää molekyylin ominaisuuksien oppimiseen. Vain tietyt molekyylit voivat absorboida valoa tällä alueella.
Kromoforit
Molekyylejä, jotka absorboivat valoa näillä aallonpituuksilla, kutsutaan kromoforeiksi. Kromoforit ovat molekyylin funktionaalisia ryhmiä, jotka absorboivat valoa tällä UV- ja näkyvän valon alueella. Niille on useimmiten ominaista delokalisoituneet pii-elektronit. Pi-elektronit viittaavat eräänlaiseen sidokseen, joka syntyy pi-orbitaaleiksi kutsuttujen elektroniorbitaalien välillä. Kun molekyylissä on paljon tällaisia pi-sidoksia, elektronit voivat delokalisoitua tai hajaantua molekyyliin. Alla olevassa kuvassa on esimerkki tällaisesta molekyylistä. Monille väriaineille (värillisille molekyyleille) on ominaista nämä delokalisoituneet pi-elektronit ja niiden väri. Näitä molekyylejä voidaan käyttää pH-indikaattoreina sen määrittämiseksi, onko liuos hapan vai emäksinen. Hapon tai emäksen lisääminen häiritsee delokalisoituneita pi-elektroneita. Tämä häiriö aiheuttaa värimuutoksen.

Lakmuspulveri
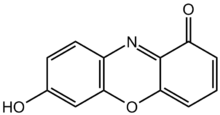
Lakmuskomponenttien kromoforin, 7-hydroksifenoksatsonin, kemiallinen rakenne.
Beerin laki
Molekyylin absorptiota voidaan käyttää molekyylin pitoisuuden määrittämiseen liuoksessa. Pitoisuuden määrittämiseen käytetään Beerin lakia. Tämä on matemaattinen suhde, joka esitetään alla olevassa yhtälössä.
A = a b c {\displaystyle A=abc}
A=absorptio, a=absorptiokerroin, b=polun pituus, c=pitoisuus.
Beerin lain komponentit voidaan määrittää testeillä. Niihin voidaan viitata myös kirjallisuudessa. Jos absorptio mitataan UV-violettispektrofotometrillä (laite, jolla mitataan molekyylien absorptiota ja aallonpituutta), tienpituus (b) liittyy testissä käytettyyn näyteastiaan. Näyteastia (nimeltään kyvetti) on valmistettu materiaalista, joka ei absorboi valoa tällä alueella. Tämän kyvetin paksuus on tunnettu arvo. Tämä on reitin pituus, jonka valo kulkee saavuttaakseen näytteen. Molaarinen absorptiokerroin voidaan laskea mittaamalla tunnetun konsentraation ja tunnetun tienpituuden omaavan näytteen absorptio. Absorptiokertoimen yksiköt ovat riippuvaisia polun pituuden ja konsentraation yksiköistä. Molaarisen absorptiokertoimen yksiköt ovat L mol-1 cm-1, kun konsentraatioyksikköinä käytetään molaarisuutta. Absorptiokyky on mitta, jolla mitataan, kuinka voimakkaasti molekyyli absorboi valoa tietyllä aallonpituudella. Kun tämä vakio on määritetty, tuntemattomat pitoisuudet voidaan määrittää tästä suhteesta.

Beckman DU640 UV/Vis -spektrofotometri.
Etsiä
