Molekyyli: määritelmä, rakenne, sidokset ja esimerkit
Molekyyli määritelmä, rakenne ja sidokset selitetty selkeästi, atomien valenssi, olomuodot ja molekyylikaavat esimerkein kuten glukoosi C6H12O6
Molekyyli on pienin mahdollinen määrä kemiallista ainetta. Jos molekyyli jaettaisiin pienempiin osiin, se olisi eri aine.
Molekyylit koostuvat atomeista, jotka ovat kiinnittyneet toisiinsa tiettyyn muotoon tai muotoon. Kaikki atomien yhdistelmät eivät ole yhtä mahdollisia; atomit muodostavat tiettyjä muotoja mieluummin kuin toisia. Niillä on myös erilainen valenssi. Esimerkiksi happiatomeilla on aina kaksi sidosta toisten atomien kanssa, hiiliatomeilla on aina neljä sidosta toisten atomien kanssa ja typpiatomeilla on aina kolme sidosta toisten atomien kanssa.
Kaasujen kineettisessä teoriassa termiä molekyyli käytetään usein kaikista kaasumaisista hiukkasista niiden koostumuksesta riippumatta. Tämän määritelmän mukaan jalokaasuatomeja pidetään molekyyleinä, koska ne ovat itse asiassa yksiatomisia molekyylejä.
Kaasuissa, kuten ilmassa, molekyylit vain lentävät ympäriinsä. Nesteissä, kuten vedessä, molekyylit ovat kiinni toisissaan, mutta ne voivat silti liikkua. Kiinteissä aineissa, kuten sokerissa, molekyylit voivat vain värähdellä. Neljännessä aineen tilassa, jota kutsutaan plasmaksi, atomit ovat ionisoituneita eivätkä voi muodostaa molekyylejä.
Molekyylikaavan avulla voit kirjoittaa molekyylin kaikkien atomien numerot. Esimerkiksi glukoosin molekyylikaava on C6H12O6. Se tarkoittaa, että yksi glukoosimolekyyli koostuu kuudesta hiiliatomista, kahdestatoista vetyatomista ja kuudesta happiatomista.
Mitä molekyylillä tarkoitetaan käytännössä
Molekyyli tarkoittaa yleensä joukkoa atomeja, jotka on sidottu yhteen pysyvämmällä tavalla kuin satunnaiset törmäykset. Monet aineet, erityisesti orgaaniset yhdisteet (esim. sokerit, proteiinit, lipidit), muodostuvat selvästi määritellyistä molekyyleistä. Sen sijaan ionisissa aineissa, kuten NaCl, ei ole yksittäisiä molekyylejä vaan kiderakenteita (ioniverkkoja); näissä tapauksissa puhutaan usein kaava‑yksiköstä eikä molekyylistä.
Molekyylin rakenne ja sidokset
- Kovalenttiset sidokset: atomit jakavat elektroneja muodostaen vahvoja sidoksia (esim. H–H, C–H, O–H). Useimmat orgaaniset molekyylit koostuvat kovalenttisista sidoksista.
- Ionic sidokset: syntyvät varaukseltaan erimerkkisten ionien välille; ne eivät muodosta erillisiä molekyylejä samalla tavalla kuin kovalenttiset yhdisteet.
- Metallisidokset: esiintyvät metallien välillä, jolloin elektronit delokalisoituvat.
Atomien valenssi kertoo yleensä, kuinka monta sidosta atomi voi muodostaa tavallisissa olosuhteissa (esim. hiili tyypillisesti 4, happi 2, typpi 3), mutta poikkeuksiakin on (radikaalit, koordinaatiosidokset, kvanttimekaaniset vaikutukset). Lisäksi molekyylin kolmiulotteinen muoto (esim. tetraedri, trigonaalinen planarisuus) määräytyy elektroniparien repulsioteorian ja hybridisaation perusteella.
Molekyylikaavat ja isomeria
Peruskaavat, joita käytetään:
- Summakaava (molekyylikaava): kertoo atomien lukumäärän (esim. C6H12O6).
- Empiirinen kaava: näytetään suhteellisina pienimpinä kokonaislukusuhteinä.
- Rakennekaava: kuvaa, miten atomit ovat sitoutuneet toisiinsa; antaa tietoa sidoksista ja molekyylin muodosta.
Isomeria tarkoittaa sitä, että sama summa‑ tai empiirinen kaava voi vastata useita erilaisia rakennejärjestelyjä (isomeerejä) — esimerkiksi glukoosin eri muotoja tai orgaanisten yhdisteiden cis/trans- ja optisia isomeerejä.
Välimolekulaariset voimat
Molekyylien välillä vaikuttavat voimat (ei‑kovalenttiset) vaikuttavat aineen olomuotoon ja ominaisuuksiin:
- Dispersiovoimat (Londonin voimat) – heikot, mutta kaikissa molekyyleissä esiintyvät.
- Dipoli‑dipolisidokset – polaaristen molekyylien välinen vetovoima.
- Vetysidokset – erityisen vahvat dipoli‑dipolisidokset, kun H on sidoksissa F, O tai N atomien kanssa; esim. veden korkeampi kiehumispiste selittyy vetysidoksilla.
Olomuodot ja molekyylien liike
Molekyylien liikkuvuus riippuu olomuodosta ja lämpötilasta:
- Kaasuissa molekyylit liikkuvat vapaasti ja törmäilevät toisiinsa.
- Nesteissä molekyylit ovat lähempänä toisiaan ja voivat liukua ohi toistensa; vetysidokset ja muut välimolekulaariset voimat rajoittavat liikettä.
- Kiinteissä aineissa molekyylit ovat paikallaan kidehilassa ja voivat pääasiassa värähdellä.
- Plasma‑tilassa atomit ovat osittain tai täysin ionisoituneita, jolloin pysyvien molekyylien muodostuminen on vaikeaa.
Esimerkkejä ja käsitteitä
- Yksinkertaisia diatomisia molekyylejä: H2, O2, N2.
- Yksiatomiset “molekyylit”: jalokaasut (He, Ne, Ar) — kinetiikassa niitä voidaan käsitellä yksittäisinä kaasumaisina hiukkasina.
- Esimerkki orgaanisesta molekyylistä: glukoosi (C6H12O6).
- Karbonaattien tai ionisten yhdisteiden kohdalla (esim. NaCl) ei ole erillisiä molekyylejä vaan kiderakenne.
Molekyylin massa ja molimäärä
Molekyylin moolimassa (g/mol) lasketaan yhteen atomien atomimassoista. Yksi mooli sisältää Avogadron luvun (noin 6,022×10^23) verran molekyylejä tai kaava‑yksiköitä; tämä on käytännön tasolla tärkeä käsite, kun mitataan aineiden määriä kemiallisissa reaktioissa.
Yhteenveto
Lyhyesti: molekyyli on pysyvämpi atomien yhdistelmä, joka määrittää aineen kemialliset ominaisuudet. Molekyylien ominaisuudet riippuvat sidoksista, rakenteesta ja välimolekulaarisista voimista, ja ne selittävät, miksi aineet käyttäytyvät eri tavoin eri olomuodoissa.
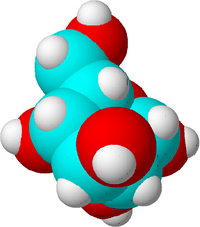
Tämä on sokerimolekyyli. Hiiliatomit on merkitty sinisellä, happiatomit punaisella ja vetyatomit valkoisella, jotta erot näkyisivät. Todellisuudessa atomeilla ei ole väriä.
Bonding
Jotta molekyyli voisi olla olemassa, atomien on pysyttävä yhdessä. Tämä tapahtuu, kun kaksi atomia jakaa elektroneja. Sen sijaan, että elektroni kiertäisi vain yhtä atomia, se kiertää nyt kahta atomia. Tätä kutsutaan kovalenttiseksi sidokseksi. Joskus jaetaan useampi kuin yksi elektroni. Mitä enemmän elektroneja jaetaan, sitä vahvemmaksi sidos muodostuu ja sitä vahvemmin atomit pysyvät yhdessä.
Siteitä voidaan myös purkaa. Koska useimmat sidokset vaativat energiaa muodostuakseen, ne myös luovuttavat energiaa hajotessaan. Ennen kuin useimmat sidokset katkeavat, molekyyliä on kuitenkin lämmitettävä. Silloin atomit alkavat liikkua, ja kun ne liikkuvat liikaa, sidos katkeaa. Molekyylejä, joiden rikkoutuminen vaatii vähemmän energiaa kuin ne luovuttavat rikkoutuessaan, kutsutaan polttoaineiksi. Esimerkiksi kynttilä vain istuu paikallaan eikä mitään tapahdu. Mutta kun sytytät sen tulitikulla, se palaa pitkään. Tulitikku tuo energiaa ensimmäisten sidosten katkaisemiseen, jotka vapauttavat tarpeeksi energiaa alla olevien sidosten katkaisemiseen, kunnes kynttilä on palanut loppuun.
On myös ionisidoksia.
Kysymyksiä ja vastauksia
K: Mikä on molekyyli?
V: Molekyyli on pienin mahdollinen määrä kemiallista ainetta. Se koostuu atomeista, jotka ovat kiinnittyneet toisiinsa tiettyyn muotoon tai muotoon.
K: Kuinka monta sidosta happi-, hiili- ja typpiatomeilla on?
V: Happiatomeilla on aina kaksi sidosta muiden atomien kanssa, hiiliatomeilla on aina neljä sidosta muiden atomien kanssa ja typpiatomeilla on aina kolme sidosta muiden atomien kanssa.
K: Mitä kaasujen kineettinen teoria sanoo molekyyleistä?
V: Kaasujen kineettisen teorian mukaan termiä molekyyli käytetään usein kaikista kaasumaisista hiukkasista niiden koostumuksesta riippumatta. Tämä tarkoittaa, että jalokaasuatomeja pidetään molekyyleinä, koska ne ovat itse asiassa yksiatomisia molekyylejä.
K: Miten molekyylit käyttäytyvät eri tiloissa?
V: Ilman kaltaisissa kaasuissa molekyylit vain lentelevät ympäriinsä. Nesteissä, kuten vedessä, molekyylit ovat kiinni toisissaan, mutta ne voivat silti liikkua. Kiinteissä aineissa, kuten sokerissa, molekyylit voivat vain värähdellä. Plasmassa (aineen neljäs olomuoto) atomit ovat ionisoituneita eivätkä voi muodostaa molekyylejä.
K: Mikä on molekyylikaava?
V: Molekyylikaavaa käytetään molekyylin kaikkien atomien lukumäärien kirjoittamiseen. Esimerkiksi C6H12O6 tarkoittaa yhtä glukoosimolekyyliä, joka koostuu kuudesta hiiliatomista, kahdestatoista vetyatomista ja kuudesta happiatomista.
Etsiä