Boylen laki (Boyle–Mariotte): paine ja tilavuus ideaalikaasuissa
Boylen laki (Boyle–Mariotte): miten paine ja tilavuus kääntäen vaikuttavat ideaalikaasuissa — selkeät kaavat, laskuesimerkki ja historiallinen tausta.
Boylen laki (myös Mariotten laki ja Boyle–Mariotten laki) on ideaalikaasuja koskeva laki, joka kuvaa paineen ja tilavuuden välistä riippuvuutta vakiomassan ideaalikaasun tapauksessa, kun lämpötila pidetään vakiona.
Kun kiinteä määrä ideaalikaasua pidetään kiinteässä lämpötilassa, P (paine) ja V (tilavuus) ovat kääntäen verrannollisia.
Matemaattinen muoto
Lyhyesti:
P ∝ 1 V {\displaystyle P\propto {\frac {1}{V}}}
tai
P V = k {\displaystyle PV=k}
missä P on kaasun paine, V on kaasun tilavuus ja k on vakio, joka riippuu kaasun määrästä ja lämpötilasta. Tämä voidaan johtaa yleisemmästä ideaalikaasun tilanyhtälöstä PV = nRT: jos määriä (n) ja lämpötila (T) pidetään vakiona, on PV vakio.
Fysikaalinen selitys
- Boylen laki pätee ideaalikaasun oletuksella (kaasun hiukkaset ovat pistemäisiä, eivät vuorovaikuta muualla kuin elastisissa törmäyksissä).
- Kun tilavuus pienenee isokseen määrään nähden samassa lämpötilassa, hiukkasten kohtaamistiheys kasvaa ja siten törmäysten määrä ja impulssivuodot säiliön seinämiin kasvavat → paine kasvaa.
- Lakea kutsutaan isotermeettiseksi laiksi, koska lämpötila on vakio.
Esimerkki
Kuvitellaan, että kaasu on aluksi paineessa (P1) ja tilavuudessa (V1). Kun paine muuttuu arvoon (P2), uusi tilavuus on (V2). Boylen lain mukaan:
P 1 V 1 = k {\displaystyle P_{1}V_{1}=k}
P 2 V 2 = k {\displaystyle P_{2}V_{2}=k}
Koska vakio k on sama molemmissa tilanteissa, saadaan
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}}
Esimerkki: Kaasun paine on 3 atm ja tilavuus 5 litraa. Jos paine alennetaan 2 atm:iin, mikä on tilavuus?
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}}
V 2 = P 1 V 1 P 2 {\displaystyle V_{2}={\frac {P_{1}V_{1}}{P_{2}}}}
V 2 = 3 ∗ 5 2 {\displaystyle V_{2}={\frac {3*5}{2}}}}
V 2 = 15 2 {\displaystyle V_{2}={\frac {15}{2}}}}
V 2 = 7.5 {\displaystyle V_{2}=7.5}
∴ Tilavuus on 7,5 litraa. (HUOM: yksiköt on pidettävä johdonmukaisina; tässä käytettiin atm ja litraa — koska suhde on suora, yksiköt sallitaan, kunhan ne ovat samoja alku- ja loppuarvoissa.)
Rajoitukset ja soveltuvuus
- Boylen laki pätee hyvin harvojen hiukkasten olosuhteissa ja kohtuullisilla paineilla — eli ideaalikaasun approksimaation ollessa pätevä. Suurilla paineilla ja alhaisilla lämpötiloilla todelliset kaasut poikkeavat Boylen laista.
- Laki edellyttää vakioista lämpötilaa (isoterminen prosessi) ja vakioista kaasun määrää (ei lisäystä tai poistamista).
- Boylen laki voidaan yhdistää muihin kaasulakeihin (esim. Charlesin laki) muodostamaan yhdistetyn kaasulain tai johtaa suoraan ideaalikaasun tilanyhtälöstä.
Lisätiedot
Graafisesti riippuvuus P versus V isotermeissä piirtää hyperbolan, koska P = k / V. Mittauksissa lause riippuvuuden testaamiseksi tehdään usein isotermejä puristamalla tai laajentamalla kaasua hitaasti, jotta lämpötila pysyy vakiona.
Robert Boyle löysi lain vuonna 1662, ja Edme Mariotte löysi sen itsenäisesti vuonna 1679. Tämän vuoksi laki kantaa molempien nimet.
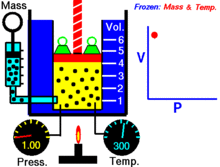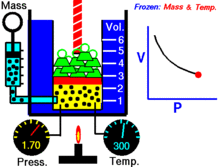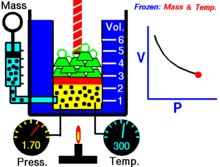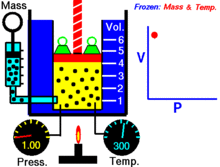
Animaatio, joka osoittaa paineen ja tilavuuden välisen suhteen.Kaasun määrä ja lämpötila ovat vakioita.
Kysymyksiä ja vastauksia
K: Mikä on Boylen laki?
V: Boylen laki (myös Mariotten laki ja Boyle-Mariotten laki) on ideaalikaasuja koskeva laki, jonka mukaan vakiolämpötilassa pidettävän kiinteän ideaalikaasumäärän paine (P) ja tilavuus (V) ovat kääntäen verrannollisia.
Kysymys: Miten Boylen laki voidaan ilmaista matemaattisesti?
V: Boylen laki voidaan ilmaista matemaattisesti muodossa P ∝ 1/V tai PV = k, jossa P on kaasun paine, V on kaasun tilavuus ja k on vakio.
K: Kuka löysi tämän lain?
V: Robert Boyle löysi lain vuonna 1662 ja sen jälkeen Edme Mariotte itsenäisesti vuonna 1679.
K: Mitä tarkoittaa, kun sanotaan, että P ja V ovat kääntäen verrannollisia?
V: Tämä tarkoittaa, että kun toinen kasvaa, toinen pienenee samassa suhteessa - jos siis pienennetään tietyn määrän kaasua tietyssä paineessa sisältävän säiliön tilavuutta, paine kasvaa, koska hiukkasten väliset törmäykset lisääntyvät, koska ne ovat pienemmässä tilassa.
K: Miten Boylen lakia käytetään paineen tai tilavuuden muutosten laskemiseen?
V: Boylen lakia voidaan käyttää paineen tai tilavuuden muutosten laskemiseen käyttämällä kahta yhtälöä - P1V1=k ja P2V2=k - jossa k pysyy vakiona, kun taas joko P1/V1 tai P2/V2 muuttuu sen mukaan, mitä yrität laskea.
Kysymys: Voimmeko soveltaa tätä lakia myös todellisiin kaasuihin?
V: Ei - tätä lakia sovelletaan vain ideaalikaasuihin, koska niiden välillä ei ole molekyylien välisiä voimia.
Etsiä








