Kromatografia – erotusmenetelmä biokemiassa ja analyyttisessä kemiassa
Kromatografia – tehokas erotusmenetelmä biokemiassa ja analyyttisessä kemiassa: erottaa seokset kiinteän ja liikkuvan faasin avulla tarkasti ja nopeasti.
Kromatografia on menetelmä, jossa käytetään sekoitettuja aineita ja joka riippuu niiden nopeudesta, jolla ne liikkuvät erityisten väliaineiden tai kemiallisten aineiden läpi. Se koostuu kiinteästä faasista (kiinteä aine) ja liikkuvasta faasista (neste tai kaasu). Liikkuva faasi virtaa pysyvän faasin läpi. Kromatografiaa käytetään paljon biokemiassa ja analyyttisessä kemiassa.
Periaate
Kromatografian keskeinen idea on, että sekoituksen eri komponentit jakautuvat eri tavalla kahden faasin välillä. Pysyvä faasi (stationary phase) voi olla kiinteä aine tai viskoosi neste kiinteällä kantajalla ja liikkuva faasi (mobile phase) on neste tai kaasu, joka kuljettaa analyytit läpi. Erot perustuvat mm. komponenttien polaarisuuteen, kokoihin, varauksiin ja affinityyn tiettyihin ligandeihin. Käytännössä jokainen yhdiste pysyy faaseissa eri ajan, mikä johtaa erottuvaan kulkeutumiseen ja muodostaa kromatogrammin (piikkiäjan tai pitoisuuden funktiona).
Yleisimmät kromatografiatyypit
- Paperi- ja ohutkerroskromatografia (TLC) – yksinkertaisia, edullisia menetelmiä näytteiden nopeaan seurantaan ja kvalitatiiviseen analyysiin.
- Kolonnikromatografia – käytetään sekä analyyttiseen että preparatiiviseen erotteluun; vaakasuorat tai pystysuorat kolonnit, erilaisia täyteaineita.
- Nestekromatografia (LC) – yleinen laboratoriotyökalu; sisältää HPLC:n (high-performance liquid chromatography), jossa käytetään korkeaa painetta ja pieniä hiukkasia parempaan resoluutioon.
- Kaasukromatografia (GC) – sopii höyrystettäville, lämpötilassa stabiileille yhdisteille; usein yhdistetty massaspektrometriaan (GC-MS).
- Ioninvaihto- eli ionikromatografia – erottaa ioneja ja varautuneita molekyylejä vaihtamalla ne vastakkaisesti varautuneella faasilla.
- Kokoero- eli suodatuskromatografia (gel-filtraatio) – erot perustuvat molekyylikokoon; yleisesti proteiinien ja makromolekyylien puhdistuksessa.
- Affinity-kromatografia – hyödyntää spesifisiä sitoutumisreaktioita (esim. antigeni–antibody, His-tägäys); erittäin selektiivinen puhdistukseen.
- Chiral-kromatografia – erottaa enantiomeerit käyttämällä kätisiä (chiral) pysyviä faaseja.
Sovellukset biokemiassa ja analyyttisessä kemiassa
- Puhdistus ja erottelu: proteiinit, peptidit, nukleiinihapot, metabolit ja luonnontuotteet.
- Kvalitatiivinen tunnistus: yhdistettä voidaan tunnistaa säteilytunnistimien tai massaspektrometrin avulla.
- Kvantitatiivinen analyysi: pitoisuuksien määritys esimerkiksi lääkkeissä, ympäristönäytteissä ja biokemiallisissa kokeissa.
- Laadunvalvonta ja prosessikemia: raaka-aineiden sekä lopputuotteiden puhtaus- ja identiteettitestit.
Detektorit ja yhdistelmät
Kromatografian yhteydessä käytettyjä detektoreita ovat mm. UV/VIS, fluoresenssi, refraktometri, johtokyky- (conductivity) ja massaspektrometri (LC-MS, GC-MS). LC-MS ja GC-MS yhdistävät erottelun tunnistukseen ja tarjoavat korkean herkkyyden ja spesifisyyden.
Käytännön tekijät, jotka vaikuttavat erotteluun
- Faasejen kemia: pysyvän ja liikkuvan faasin polariteetti ja kemialliset ominaisuudet.
- pH, ionivahvuus ja lämpötila – vaikuttavat etenkin proteiinien ja ionisoituvien yhdisteiden käyttäytymiseen.
- Virtausnopeus ja paine – suurempi virtaus nopeuttaa analyysiä mutta voi heikentää resoluutiota.
- Kolonnin pituus, halkaisija ja hiukkaskoko – pienemmät hiukkaset parantavat erotuskykyä mutta vaativat korkeampia paineita.
- Gradienttieluutio vs isokrattinen eluute – gradientit auttavat erottamaan laajaa ainekirjoa tehokkaammin.
Tulosten tulkinta ja rajoitukset
Kromatogrammissa kukin yhdiste näkyy piikkinä; tärkeimpiä tunnuslukuja ovat retentioaika, piikin korkeus/ala (pitoisuus), sekä resoluutio eri piikkien välillä. Huonot piikkimuodot (tailing, fronting) tai matala resoluutio voivat viitata kolonnin ongelmiin, näytteen ylikuormitukseen tai sopimattomaan eluutioparametriin. Rajoituksia ovat mm. näytematriisin häiriöt, rajoitettu lastauskapasiteetti preparatiivisissa sovelluksissa ja laitteiston kustannukset (esim. HPLC, MS).
Näytteen esikäsittely
Usein tarvitaan suodatusta, sentrifugointia, konsentrointia tai desalting-toimenpiteitä ennen kromatografiaa, jotta kolonnia ei tukita ja mittaukset ovat luotettavia. Esikäsittely valitaan analyytin ja käytetyn menetelmän mukaan.
Yhteenveto
Kromatografia on monipuolinen ja tehokas erotusmenetelmä, jota käytetään laajasti biokemiassa ja analyyttisessä kemiassa analyysiin, tunnistukseen ja puhdistukseen. Oikein valituilla faaseilla, parametreilla ja detektoriyhdistelmillä voidaan saavuttaa korkea herkkyys, selektiivisyys ja toistettavuus. Menetelmän valinta perustuu analyytin kemiallisiin ominaisuuksiin, tarvittavaan herkkyyteen ja määrälliseen tai kvalitatiiviseen tarpeeseen.
Tasokromatografia
Stationäärifaasi on tasainen taso, kuten paperi, tai aine lasilla.
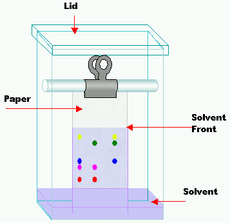
Paperikromatografia
Paperikromatografia on tekniikka, jolla erotetaan ja tunnistetaan seoksia, jotka ovat (tai voivat olla) värillisiä. Se on suurelta osin korvattu ohutkerroskromatografialla, mutta se on edelleen tehokas opetusväline. Kaksisuuntaisessa paperikromatografiassa, jota kutsutaan myös "kaksiulotteiseksi kromatografiaksi", käytetään kahta liuotinta ja käännetään paperia 90° niiden välillä. Se on käyttökelpoinen eroteltaessa monimutkaisia seoksia, jotka koostuvat samankaltaisen polariteetin omaavista yhdisteistä, esimerkiksi aminohapoista. Alun perin käytetyt yhdisteet varmistavat, että tiedät, onko väri puhdas (vain yksi aine) vai seos (useita aineita).
Ohutkerroskromatografia
Ohutkerroskromatografia (TLCC) on yleinen laboratoriotekniikka, joka muistuttaa paperikromatografiaa. Paperisen stationäärifaasin sijasta siinä käytetään ohutta adsorbenttikerrosta, kuten silikageeliä, alumiinioksidia tai selluloosaa tasaisella alustalla. Paperikromatografiaan verrattuna sen etuna ovat nopeammat ajot, paremmat erotukset ja mahdollisuus valita eri adsorbenttien välillä. Vielä parempaa erotuskykyä ja kvantifiointia varten voidaan käyttää korkean erotuskyvyn TLC:tä.
Kromatografiapurkki
Pylväskromatografia
Pylväskromatografia erottaa yhdisteet käyttämällä monia kemiallisia toimia testattavan kemikaalin ja kromatografiakolonnin (sauva, johon on sekoitettu erityiskemikaaleja) välillä. Kolonnia käytetään joko painovoiman tai pumpun avulla.
Testattavaa sekoitettua ainetta lisätään pieni määrä, ja se hidastuu tietyn kemiallisen tai fysikaalisen toiminnan vaikutuksesta kromatografiakolonnissa olevien kemikaalien kanssa. Hidastuksen määrä riippuu testattavan aineen kemikaalityypistä ja eri faaseista. Aikaa, jolloin tietty kemikaali eluoituu (tulee ulos kolonnin päästä), kutsutaan "retentioajaksi", ja sitä ajatellaan olevan vain yksi yhdelle kemikaalille.
Kolonnikromatografian yleisin stationäärifaasi on silikageeli, jota seuraa alumiinioksidi. Aiemmin on käytetty myös selluloosajauhetta. Liikkuva faasi on joko puhdas liuotin tai liuottimien seos. Se valitaan siten, että liuottimen käyttöaika ja -määrä on mahdollisimman vähäinen, mutta samalla testattavat kemikaalit erotetaan selvästi toisistaan.
Korkean suorituskyvyn nestekromatografian tulokset
HPLC
Korkean suorituskyvyn nestekromatografiaa (HPLC) kutsutaan joskus myös korkeapainenestekromatografiaksi. Se on kolonnikromatografiaa, joka suoritetaan paineen alaisena prosessin nopeuttamiseksi.
HPLC:ssä käytettävät yleiset liuottimet ovat veden tai erilaisten orgaanisten nesteiden seoksia (yleisimmät ovat metanoli, etanoli tai asetonitriili).
Kysymyksiä ja vastauksia
K: Mitä on kromatografia?
V: Kromatografia on prosessi, jossa seoksen komponentit erotetaan toisistaan sen perusteella, kuinka nopeasti ne liikkuvat tiettyjen väliaineiden läpi.
K: Mitkä tekijät määräävät kromatografian tuloksen?
V: Kromatografian tulos riippuu siitä, kuinka nopeasti sekoitetut aineet liikkuvat erityisten väliaineiden tai kemiallisten aineiden läpi.
K: Mitkä kaksi vaihetta osallistuvat kromatografiaan?
V: Kromatografia koostuu stationäärifaasista (kiinteä aine) ja liikkuvasta faasista (neste tai kaasu).
K: Miten liikkuva faasi liikkuu kromatografiassa stationäärifaasin läpi?
V: Liikkuva faasi virtaa pysyvän faasin läpi.
K: Mitkä ovat tärkeimmät kromatografiaa käyttävät alat?
V: Kromatografiaa käytetään merkittävästi biokemiassa ja analyyttisessä kemiassa.
K: Mikä on kromatografian stationäärifaasi?
V: Kromatografiassa stationäärifaasilla tarkoitetaan kiinteää ainetta, joka on vuorovaikutuksessa seoksen komponenttien kanssa ja saa ne hidastumaan tai pysähtymään.
K: Mikä on liikkuva faasi kromatografiassa?
V: Kromatografiassa liikkuvalla faasilla tarkoitetaan nestettä tai kaasua, joka virtaa pysyvän faasin läpi ja kuljettaa seoksen komponentteja eri nopeuksilla.
Etsiä