Vetyioni – vedyn ionit ja isotoopit (H+, H−)
Tutustu vetyioneihin (H+, H−) ja vedyn isotooppeihin: ominaisuudet, varaukset ja kemiallinen merkitys käytännön esimerkein ja selkeällä kielellä.
IUPAC suosittelee vetyionia yleisnimitykseksi kaikille vedyn ja sen isotooppien ioneille. Ionin varauksesta riippuen niitä on kahta tyyppiä: positiivisesti varautuneita ja negatiivisesti varautuneita ioneja.
Mitä vetyionit ovat?
Vetyionit ovat vedyn atomeista syntyviä varautuneita hiukkasia. Ne voivat olla positiivisia (puuttuva elektroni, merkitään yleensä H+) tai negatiivisia (lisäelektroni, merkitään H−). IUPAC:n suosituksen mukainen yleisnimi "vetyioni" kattaa sekä vedyn että sen isotooppien ionit.
Positiivinen vetyioni (H+)
H+ on käytännössä protoni, eli vedyn ytimessä oleva yksittäinen protoni ilman elektronia. Vapaata protonia ei yleensä esiinny pitkiä aikoja eristettynä: se sitoutuu nopeasti ympäröiviin molekyyleihin, erityisesti veteen.
- Vesiliuoksessa H+ esiintyy yleensä muodossa H3O+ (hydronium) ja useimmiten solvatoituneina klustereina kuten H5O2+ jne.
- H+ on keskeinen käsite happo‑emäs -reaktioissa: pH-arvo kuvaa vapaiden vetyionien aktiivisuutta liuoksessa.
- Protonin liikkuvuus vesiliuoksissa on poikkeuksellisen suuri Grotthussin mekanismin ansiosta, jossa protoni "hyppää" vety‐siltojen kautta.
- Kaikkien vedyn isotooppien positiiviset ionit merkitään analogisesti, esim. D+ (deuteron), T+ (triton).
Negatiivinen vetyioni (H−) — hydridi
H− tunnetaan nimellä hydridi. Se on voimakas emäs ja hyvin pelkistävä aine katalyyttisissa ja synteettisissä reaktioissa.
- Inorgaanisissa yhdisteissä hydridi voi esiintyä ionisena (esim. NaH) tai kovalenttisesti sidottuna (esim. metallien ja kompleksien hydridit).
- Usein käytettyjä hydridejä ovat natriumhydridi (NaH), litiumalumiinihydridi (LiAlH4) ja natriumborhydridi (NaBH4) — viimeksi mainittu on pehmeämpi pelkistin orgaanisessa kemiassa.
- Hydridit reagoivat veden kanssa yleensä tuottaen vetykaasua: NaH + H2O → NaOH + H2↑.
Isotoopit ja niiden ionit
Vetyllä on kolme yleisesti tunnettua isotooppia: protium (1H), deuterium (2H, merkitään D) ja tritium (3H, merkitään T). Jokaisella isotoopilla voi olla vastaava ioni (esim. H+, D+, T+ ja H−, D−, T−).
- Deuteriumin ja tritiumin ionit käyttäytyvät kemiallisesti samankaltaisesti kuin protiumin ionit, mutta niiden massaero aiheuttaa isotoppiefektejä (esimerkiksi reaktionsiirtoihin ja spektriin).
- Deuteriumia käytetään usein merkkiaineena ja tutkimuksissa (esim. raskas vesi D2O). Tritium on radioaktiivinen ja käytetään muun muassa jäljitysaineena ja ydinpolttoaineen tutkimuksissa.
Kemialliset ominaisuudet ja reaktiivisuus
- H+ tekee aineista happamia: hapot luovuttavat protonin ja emäksen vastaanottaessa protonin muodostuu uutta sidosta.
- H− on vahva emäs ja pelkistin; se voi luovuttaa elektronin tai toimia elektroniparin lähteenä kemiallisissa reaktioissa.
- Monissa metalli‑orgaanisissa yhdisteissä hydrideillä on tärkeä rooli katalyysissä, vety‐siirroissa ja synteettisissä reaktioissa.
- Vetyionien läsnäolo vaikuttaa sähkökemiallisiin ilmiöihin, korroosioon ja sähkönjohtavuuteen erilaissa materiaaleissa.
Esiintyminen ja valmistus
- Luonnossa vetyionit esiintyvät laajalti liuenneina vesissä, happo‑emäs‑reaktioissa ja kaasufaasissa tähtien ja avaruuden olosuhteissa.
- Hydridit valmistetaan usein suoraan metallien ja vedyn reaktioina (esim. Na + 1/2 H2 → NaH) tai kemiallisesti synteesimenetelmin kuten alkyylien pelkistämisellä.
- Laboratorioissa ja teollisuudessa käytetään monia reagensseja, jotka luovuttavat H− (esim. LiAlH4) tai H+ (hapot) haluttuihin reaktioihin.
Käyttö ja merkitys
- Vetyioneilla on keskeinen rooli kemian peruskäsitteissä: happo‑emäs‑reaktioissa, elektrolyysissä ja katalyysissä.
- Hydridit ovat tärkeitä pelkistimiä orgaanisessa synteesissä ja teollisuudessa.
- Isotooppien ionit (D+, T+) ovat hyödyllisiä tutkimuksessa, spektroskopiassa ja ydinteknisissä sovelluksissa.
- Avaruudessa esimerkiksi H3+ on merkittävä ioninen laji tähtienvälisessä mediassa ja planeettojen ilmakehissä, ja sen spektroskopia antaa tietoa olosuhteista.
Turvallisuus ja ympäristö
- Monet hydrideistä reagoivat voimakkaasti veden kanssa ja voivat tuottaa palavaa vetykaasua; jotkin ovat myös syövyttäviä tai helposti syttyviä ilmassa.
- Tritium on radioaktiivinen ja sen käsittelyssä on noudatettava erityisiä säteilyturvallisuusmääräyksiä.
- Vetykaasu itsessään on erittäin herkästi syttyvä — asianmukaiset varotoimet ovat tarpeen varastoinnissa ja käytössä.
Yhteenvetona: vetyionit kattavat laajan joukon hiukkasia, joilla on keskeinen merkitys kemiallisissa reaktioissa, teollisuudessa, tutkimuksessa ja luonnonilmiöissä. Niiden kemiallinen käyttäytyminen riippuu siitä, onko kyseessä protoni (H+) vai hydridi (H−), sekä siitä, mikä vetyisotooppi on kyseessä.
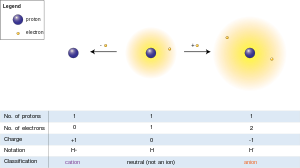
Vetyatomi (keskellä) sisältää yhden protonin ja yhden elektronin. Elektronin poistaminen antaa kationin (vasemmalla), kun taas elektronin lisääminen antaa anionin (oikealla).
Kationi (positiivisesti varautunut)
Kun vety menettää elektroninsa, voi muodostua kationeja:
- Hydroni: yleisnimitys, joka viittaa minkä tahansa vedyn isotoopin positiiviseen ioniin (H+ ).
- Proton: 1H+ (eli protiumin kationi).
- Deuteron:2 H+ , D+
- Triton: 3H+ , T+
Näiden kationien ja veden välisessä reaktiossa syntyviä ioneja sekä niiden hydraatteja kutsutaan myös vetyioneiksi.
Happojen yhteydessä "vetyioneilla" tarkoitetaan yleensä hydroneja.
Anioni (negatiivisesti varautunut)
Vetyanionit muodostuvat, kun lisäelektroneita hankitaan:
- Hydridi: yleisnimitys, joka viittaa minkä tahansa vedyn isotoopin negatiiviseen ioniin (H− ).
- Protide:1 H−
- Deuteridi: 2H− , D −
- Tritidi:3 H− , T −
Etsiä