Myosiini: mikä se on, rakenne, toiminta ja rooli lihassupistuksessa
Myosiini selkeä opas: rakenne, toiminta ja rooli lihassupistuksessa, ATP-riippuvainen proteiini eukaryooteissa, myosiinigeneet ja käytännön esimerkit
Myosiinit ovat ryhmä erikoistuneita proteiineja, joita käytetään lihasten supistumiseen ja liikkumiseen eukaryoottisoluissa. Myosiinit tarvitsevat ATP:tä energiaa näiden toimintojen suorittamiseen. Eukaryooteista on löydetty suuri määrä erilaisia myosiinigeenejä.
Myosiinin rakenne ja toiminta on vahvasti konservoitunut eri lajeissa. Esimerkiksi kanin lihaksen myosiini II sitoutuu ameeban aktiiniin.
Rakenne
Myosiinit koostuvat yleensä seuraavista osista:
- Moottoridomeeni (pää, head) – sisältää aktiinin sitoutumiskohdan ja ATP-ase-aktiivisuuden (ATP-hydrolyysin) ja on vastuussa mekaanisen työn tuottamisesta.
- Kaula- tai niskakohta (neck) – toimii vipuvarrena (lever arm) ja sitoo myosiinikevyet ketjut (light chains), jotka vaikuttavat liikemekaniikkaan ja säätelyyn.
- Häntäosa (tail) – mahdollistaa dimerisaation, filamenttien muodostuksen ja vuorovaikutuksen muiden proteiinien tai soluelinten kanssa.
Toimintamekanismi (aktomyoosiinikierto)
Myosiinin ja aktiinin vuorovaikutus syklissä voidaan tiivistää seuraavasti:
- ATP:n sitoutuminen myosiinin päähän aiheuttaa irtoamisen aktiinista.
- ATP:n hydrolyysi (ATP → ADP + Pi) "virittää" myosiinin pään (cocked state).
- Myosiini muodostaa uudelleen vahvan sidoksen aktiiniin ja fosfaattiryhmän (Pi) vapautuminen laukaisee power stroken, eli vipuvarren liikkeen.
- ADP:n vapautuminen päättää yhden työjakson; uusi ATP:n sitoutuminen aloittaa seuraavan sykliin.
Rooli lihassupistuksessa
Lihaksissa myosiini II muodostaa paksuja filamentteja, jotka liukuvat aktiinin ohuempien filamenttien lomitse. Strukturaalisesti tapahtuma järjestyy sarkomeereihin: myosiinipäät sitoutuvat aktiiniin ja tuottavat toistuvia voima-askelia, jotka lyhentävät sarkomeeria ja aikaansaavat lihassupistuksen.
Säätely eri lihastyypeissä:
- Luustolihaksessa aktiinin ja myosiinin vuorovaikutusta säätelee troponiini-tropomyosiini-kompleksi. Kun solunsisäinen Ca2+-pitoisuus nousee lihasaktivaation aikana, troponiini muuttuu ja paljastaa myosiinin sitoutumiskohdat aktiinissa.
- Sileässä lihaksessa myosiinin toimintaa säätelee myosiinin kevytketjun fosforylaatio. Ca2+/kalmoduliinin aktivoima myosiinivalmiuksien kinasi (MLCK) fosforyloi myosiinin säätelevän kevytketjun, mikä lisää myosiinin ATP-asa-aktiivisuutta ja supistumiskykyä.
Muut solutehtävät
Myosiinit eivät ole pelkästään lihassolujen työkaluja. Niillä on monia soluissa esiintyviä tehtäviä, kuten:
- Intracellulaarinen kuljetus — myosiini V kuljettaa vesikkelien ja organellien raskaampia kuormia pitkin aktiiniverkostoa.
- Soluliike ja lamellipodian muodostus — myosiinit osallistuvat solun liikkumiseen ja adheesioiden säätelyyn.
- Kytkentä solun pinnan tapahtumiin — myosiini I osallistuu kalvon liikkuvuuteen, endosytoosiin ja fagoosytoosin säätelyyn.
- Sytokineesi — solunjakautumisen aikana myosiinit vetävät solukalvon yhtymäkohtaa jakautuvan solun keskelle.
Säätely ja post-translatoivat muutokset
Myosiinien aktiivisuuteen vaikuttavat mm. fosforylaatio (erityisesti kevytketjujen fosforylaatio), glykosylaatio ja vuorovaikutus säätelyproteiineihin. Erilaiset signaalireitit voivat muuttaa myosiinin affiniteettia aktiinille tai ATP:n hydrolyysin nopeutta, jolloin solu voi mukauttaa voiman tuottoa ja liikettä tarpeen mukaan.
Sairaudet ja kliininen merkitys
Mutaatioita myosiinigeeneissä on yhdistetty useisiin sairauksiin. Esimerkkejä:
- Sydänlihassairaudet — mutaatiot beta-myosin heavy chain -geeneissä (esimerkiksi MYH7) voivat aiheuttaa familiaalista hypertrofista kardiomyopatiaa.
- Perinnölliset hermo- ja kuulovauriot — tiettyjen myosiinien mutaatiot (esim. myosiini VIIA) liittyvät kuulo- ja näköongelmiin.
- Ongelmia solukuljetuksessa — myosiini Va -mutaatioita on yhdistetty harvinaisiin syndroomiin, joissa solunsisäinen kuljetus häiriintyy.
Tutkimusmenetelmät
Myosiinien toimintaa tutkitaan laajasti käyttäen mm.:
- In vitro -mobiilisuus- ja ATPaasakokeita
- Yksittäismolekyylimenetelmiä kuten optiset pinsetit ja fluoresenssimikroskopia
- Rakennebiologiaa: röntgenkristallografia ja kryo-elektronimikroskopia (cryo-EM) antavat yksityiskohtaista tietoa moottoridomeenin rakenteesta
Yhteenvetona: myosiinit ovat monipuolisia motoriproteiineja, joiden perustoiminta — ATP-riippuvainen vuorovaikutus aktiinin kanssa — on evolutiivisesti säilynyt, mutta eri myosiinityypit on optimoitu erilaisiin solutehtäviin lihastyöstä solun sisäiseen kuljetukseen ja jakautumiseen.
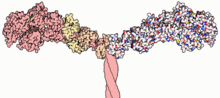
Osa myosiini II:n rakennetta
Rakenne ja toiminta
Osat
Useimmat myosiinimolekyylit koostuvat pää-, kaula- ja häntäosasta.
- Pääosa tarttuu aktiiniin ja käyttää ATP:stä saatavaa energiaa vetämiseen, jolloin lihas lyhenee.
- kaulaosa toimii vipuna.
- Häntäosa on enimmäkseen vuorovaikutuksessa muiden molekyylien tai muiden myosiinialayksiköiden kanssa. Joissakin tapauksissa hännän osa voi auttaa säätelemään liikettä.
Tehoisku
Monet myosiinimolekyylit voivat saada lihakset lyhenemään käyttämällä energiaa, joka vapautuu ATP-molekyylien hajottamisesta ADP:ksi ja fosfaattiryhmäksi. Voimahyökkäys tapahtuu, kun myosiinista vapautuu fosfaatti, joka n irti. Tämä saa myosiinin muuttamaan muotoaan niin, että se vetää aktiinia vasten. Kun ADP-molekyyli vapautuu ja uusi ATP-molekyyli liittyy myosiinin päähän, pää irtoaa aktiinista. Myosiini katkaisee uuden ATP:n, ja sykli jatkuu. Kaikkien eri myosiinimolekyylien kaikkien voimahyppyjen yhteisvaikutus saa lihaksen lyhenemään.
Etsiä