Proteiinit: aminohapot, rakenne ja solutoiminnot
Proteiinit: aminohapot, rakenne ja solutoiminnot — selkeä opas proteiinien rakenteesta, taittumisesta ja roolista soluissa. Lue lisää.
Proteiinit ovat pitkäketjuisia molekyylejä, jotka rakentuvat pienistä yksiköistä eli aminohapoista. Ne liittyvät toisiinsa peptidisidoksilla. Proteiinit voivat olla koostumukseltaan ja kooltaan hyvin erilaisia: yksinkertaisista, muutamasta kymmenestä aminohaposta koostuvista peptidiketjuista aina tuhansia aminohappoja sisältäviin monimutkaisiin komplekseihin.
Ne ovat biokemiallisia yhdisteitä, jotka koostuvat yhdestä tai useammasta polypeptidistä, jotka on taitettu pyöreään tai kuitumaiseen muotoon. Jokainen polypeptidi on lineaarinen ketju, jonka rakennuspalikat eli aminohapot ovat peräkkäin peptidisidoksin liittyneinä. Ketjun päissä ovat aminopää (N-terminus) ja karboksyylipää (C-terminus).
Polypeptidi on yksittäinen lineaarinen aminohappojen polymeeriketju. Polypeptidin aminohappojen järjestys on peräisin geenin DNA-sekvenssistä. Geenikoodi määrittelee 20 vakioaminohappoa. Pian synteesin jälkeen joitakin aminohappoja muunnetaan kemiallisesti. Tämä muuttaa proteiinin taittumista, vakautta, aktiivisuutta ja toimintaa. Joskus proteiineihin on liitetty muita kuin proteiiniryhmiä, kuten kofaktoreita (esim. metalli-ioneja tai orgaanisia ryhmiä), jotka ovat välttämättömiä tiettyjen proteiinien toiminnalle.
Proteiinit ovat välttämättömiä kaikille soluille. Muiden biologisten makromolekyylien (polysakkaridit ja nukleiinihapot) tavoin proteiinit osallistuvat lähes kaikkiin solujen prosesseihin:
Proteiinien rakenne
Proteiinien rakenne voidaan kuvata neljällä tasolla:
- Primaarirakenne: aminohappojärjestys jonossa. Muutokset tässä (mutaatio) vaikuttavat usein toimintaan.
- Sekundaarirakenne: paikalliset rakenteet, kuten α-kierrepolut ja β-laskokset, muodostuvat vety-, helmi- ja muita sidoksia napatessa aminohappoketjussa.
- Tertiaarirakenne: koko polypeptidin kolmiulotteinen taittuma, joka määrää proteiinin aktiivisen muodon ja pinnan ominaisuudet.
- Kvaternäärirakenne: useamman polypeptidiketjun (subyksikön) muodostama kompleksi, esimerkiksi hemoglobiinin neljä alayksikköä.
Amino happojen sivuketjujen (R-ryhmät) kemialliset ominaisuudet — polaarisuus, varaus, oksonit, aromaattisuus tai rikkipitoisuus — ohjaavat taittumista ja aktiivisessa paikassa tapahtuvaa molekyylien tunnistusta. Tärkeitä vuorovaikutuksia ovat vety- ja ionisidokset, disulfidisillat (kysteiinien välillä), hydrofobiset vuorovaikutukset ja van der Waals -voimat.
Proteiinien keskeiset tehtävät solussa
- Entsyymit: katalysoivat lähes kaikkia kemiallisia reaktioita soluissa (esim. DNA-polymeraasi, amylaasi). Entsyymien aktiiviset kohdat sitovat substraatit ja alentavat reaktion aktivaatiovoimaa.
- Rakenteelliset proteiinit: antavat tukea ja muodon soluissa ja kudoksissa (esim. kollageeni, keratiini).
- Kuljetus- ja varastoproteiinit: kuljettavat aineita (esim. hemoglobiini kuljettaa happea, kantajaproteiinit solukalvolla) tai varastoivat ioneja ja ravinteita (esim. ferritiini rauta).
- Viestintä ja reseptorit: solujen väliset signaalit välittyvät usein proteiinien välityksellä (reseptorit, hormonit kuten insuliini).
- Liike: supistuvat proteiinit (aktini ja myosiini) mahdollistavat lihastyön ja solun sisäisen liikenteen.
- Immuunivaste: vasta-aineet (immunoglobuliinit) tunnistavat ja neutraloivat mikrobeja ja vieraita molekyylejä.
- Solukalvon kanavat ja pumput: säätelevät ionien ja molekyylien kulkua solukalvon läpi (esim. ATP-syntaasit, ionipumput).
Proteiinisynteesi ja säätely
Proteiinisynteesi alkaa geenin ilmentymisestä: DNA transkriboidaan RNA:ksi ja mRNA käännetään ribosomeilla aminohappoketjuksi. Kullakin kolmen emäksen muodostamalla kodonilla on vastaava aminohappo, joka tuodaan ribosomiin siirtäjä-RNA:n (tRNA) toimesta. Synteesin aikana proteiinit voivat alkaa taittua jo syntetisoituessaan.
Ilmentymistä säädellään monin tavoin: geenien transkriptio, mRNA:n stabiliteetti, käännösnopeus ja post-translationaaliset modifikaatiot. Proteiinien aktiivisuutta ja sijaintia voidaan muuttaa fosforylaatiolla, glykosylaatiolla, asetylaatiolla, farnesyloinnilla, ubikitinoinnilla ja monilla muilla kemiallisilla muutoksilla.
Taittuminen, avustajat ja laatuvalvonta
Oikea kolmeulotteinen muoto on usein välttämätön proteiinin toiminnalle. Prosessia kutsutaan taittumiseksi. Väärin taittuneet proteiinit voivat muodostaa aggregaatteja, jotka ovat haitallisia solulle. Soluilla on mekanismeja, jotka auttavat taittumista ja estävät väärintaittumista:
- Silmukanaproteiinit eli chaperonit: auttavat proteiineja saavuttamaan oikean konformaation ja estävät epätarkoituksenmukaista aggregoitumista. Esimerkkejä ovat lämpöshokkiproteiinit (Hsp-sarjan proteiinit).
- Proteiinien laatuvalvonta: vialliset tai tarpeettomat proteiinit merkataan usein ubikitinilla ja hajotetaan proteasomissa tai lyysoomeissa.
Post-translationaaliset modifikaatiot
Monet proteiinit muuttuvat synteesin jälkeen. Tällaisia modifikaatioita ovat muun muassa:
- fosforylaatio (säätelee aktiivisuutta ja signalointia)
- glykosylaatio (vaikuttaa stabiliteettiin ja solukalvon proteiinien toimintaan)
- ubikitinointi (merkitsee proteiineja hajotettaviksi)
- metylaatio, asetylaatio, palmitoylaatio ja muut lipidisaatiot
Proteiinien merkitys ravitsemuksessa ja lääketieteessä
Ihmiselle proteiinit ovat välttämättömiä lihasten, entsyymien, hormonien ja monien muiden kudosten muodostumisessa. Ravinnon proteiinit pilkkoutuvat ruoansulatuskanavassa aminohapoiksi, joita elimistö käyttää omien proteiiniensa rakentamiseen. Joitakin aminohappoja ihmiskeho ei pysty synnyttämään itse (eli ne ovat välttämättömiä aminohappoja) ja ne on saatava ravinnosta. Tavallisesti listataan yhdeksän välttämätöntä aminohappoa aikuiselle: histidiini, isoleusiini, leusiini, lysiini, metioniini, fenyylialaniini, treoniini, tryptofaani ja valiini.
Useat sairaudet liittyvät proteiineihin: geneettiset mutaatiot voivat muuttaa aminohappojärjestystä ja johtaa toimintahäiriöihin, virheellisesti taittuneet proteiinit voivat kerääntyä ja aiheuttaa neurodegeneratiivisia sairauksia (esim. Alzheimerin tauti ja prionitaudit), ja monet infektiot sekä syövät liittyvät proteiinien poikkeavaan ilmentymiseen tai toimintaan. Monet lääkeaineet kohdistuvat proteiineihin (entsyymien estäjät, reseptoriantagonistit yms.).
Proteiinien tutkimusmenetelmät
Proteiineja tutkitaan monin tavoin, jotta ymmärretään niiden rakennetta ja toimintaa:
- SDS-PAGE ja Western blot: proteiinien erottelu kokonsa mukaan ja tunnistus antigeenin avulla.
- Massaspektrometria: proteiinien tunnistukseen ja post-translationaalisten modifikaatioiden kartoitukseen.
- Röntgendiffraktio (kristallografia), NMR-spektroskopia ja kryo-elektronimikroskopia (cryo-EM): kolmiulotteisten rakenteiden selvittämiseen.
- Biokemialliset entsyymi- ja sitoutumiskokeet, spektroskopia (esim. ultaviolettispektrit, CD) ja in vivo -mallit biologisen toiminnan arvioimiseksi.
- Proteiiniteknologia ja rekombinantti-DNA-menetelmät mahdollistavat proteiinien tuottamisen laboratoriossa ja muokkaamisen tutkimusta ja lääkevalmistusta varten.
Yhteenveto
Proteiinit ovat keskeisiä solun toiminnalle: ne toimivat katalyytteinä, rakenteina, viestinviejinä, kuljettajina ja monessa muussa roolissa. Niiden toiminnot määräytyvät aminohappojärjestyksen ja kolmiulotteisen rakenteen perusteella. Proteiinien synteesi, taittuminen, muokkaus ja hajoaminen ovat tiukasti säädeltyjä prosesseja, joiden häiriöt voivat johtaa sairauksiin. Nykyteknologiat tarjoavat tehokkaita tapoja tutkia ja hyödyntää proteiineja biologiassa, lääketieteessä ja bioteknologiassa.
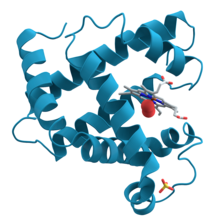
Proteiini myoglobiinin 3D-kaavio, jossa näkyy turkoosit alfahelikit. Tämän proteiinin rakenne ratkaistiin ensimmäisenä röntgenkristallografian avulla. Kierukoiden keskellä oikealla puolella on hemiryhmä (harmaalla), johon on sitoutunut happimolekyyli (punainen).
Ihmisille tarkoitetut proteiinit
Proteiineilla on erilaisia tehtäviä niiden muodon mukaan. Niitä on lihassa tai lihaksessa. Niitä käytetään kasvuun ja korjaamiseen sekä luiden vahvistamiseen. Ne auttavat kudosten ja solujen muodostamisessa. Niitä on eläimissä, kasveissa, sienissä, bakteereissa ja myös ihmiskehossa.
Lihakset sisältävät paljon proteiinia. Kun proteiini sulatetaan, se hajoaa aminohapoiksi. Näistä aminohapoista voidaan sitten rakentaa uutta proteiinia. Proteiinit muodostavat tärkeän osan elintarvikkeista, kuten maidosta, munista, lihasta, kalasta, pavuista, pinaatista ja pähkinöistä. On neljä tekijää, jotka määräävät, mitä proteiini tekee. Ensimmäinen on aminohappojen järjestys. Aminohappoja on 20 erilaista. Toinen on ketjun pienet käänteet. Kolmas on se, miten koko rakenne on taitettu. Neljäntenä on se, koostuuko se eri alayksiköistä. Esimerkiksi hemoglobiinimolekyylit koostuvat neljästä alayksiköstä.
Vahingolliset mutaatiot
Useimmat proteiinit ovat entsyymejä, ja mutaatiot voivat hidastaa tai lopettaa niiden toiminnan. 50 prosenttia ihmisen syövistä johtuu mutaatioista kasvainsuppressori p53:ssa. p53 on proteiini, joka säätelee solujen jakautumista.
Välttämättömät aminohapot
Proteiinit ovat välttämättömiä eläinten ruokavaliossa, koska eläimet eivät pysty valmistamaan kaikkia tarvitsemiaan aminohappoja (suurinta osaa niistä ne pystyvät valmistamaan). Niiden on saatava tietyt aminohapot ravinnosta. Näitä kutsutaan välttämättömiksi aminohapoiksi. Ruuansulatuksen kautta eläimet hajottavat nautitut proteiinit vapailta aminohapoiksi. Aminohappoja käytetään sitten aineenvaihdunnassa elimistön tarvitsemien entsyymien ja rakenteiden valmistukseen.
Ihmiselle on olemassa yhdeksän välttämätöntä aminohappoa, jotka saadaan ravinnosta. Nämä yhdeksän välttämättömiä aminohappoja ovat histidiini, isoleusiini, leusiini, lysiini, metioniini, fenyylialaniini, treoniini, tryptofaani ja valiini. Liha sisältää kaikkia ihmisen tarvitsemia välttämättömiä aminohappoja, useimmat kasvit eivät. Kuitenkin syömällä kasviseosta, kuten vehnää ja maapähkinävoita tai riisiä ja papuja, saadaan kaikki tarvittavat välttämättömät aminohapot. Soijatuotteet, kuten tofu, tuottavat kaikki välttämättömät aminohapot, kuten myös kvinoa, mutta ne eivät ole ainoa tapa saada ihmisen tarvitsemaa proteiinia.
Tiedemies Jöns Jacob Berzelius antoi proteiineille nimen, mutta monet muutkin tiedemiehet ovat tutkineet proteiineja.

Munanvalkuaiset sisältävät paljon proteiinia
Aiheeseen liittyvät sivut
Kysymyksiä ja vastauksia
K: Mitä proteiinit ovat?
V: Proteiinit ovat pitkäketjuisia molekyylejä, jotka rakentuvat pienistä yksiköistä, joita kutsutaan aminohapoiksi.
K: Miten aminohapot liittyvät toisiinsa?
V: Aminohapot liittyvät toisiinsa peptidisidoksilla.
K: Mikä on polypeptidi?
V: Polypeptidi on yksittäinen lineaarinen aminohappojen polymeeriketju.
K: Mistä polypeptidin aminohappojen järjestys on peräisin?
V: Polypeptidin aminohappojen järjestys tulee geenin DNA-sekvenssistä.
K: Mitä tapahtuu pian synteesin jälkeen joillekin aminohapoille?
V: Pian synteesin jälkeen jotkin aminohapot muuttuvat kemiallisesti.
K: Mitä proteiineissa olevien aminohappojen modifikaatio tekee?
V: Aminohappojen modifiointi proteiineissa muuttaa proteiinin taittumista, stabiilisuutta, aktiivisuutta ja toimintaa.
K: Koostuvatko kaikki proteiinit vain aminohapoista?
V: Ei, joskus proteiineihin on liitetty muita kuin peptidiryhmiä, kuten kofaktoreita.
Etsiä