Aktivoitumisenergia (Ea) – määritelmä, merkitys ja esimerkkejä
Ymmärrä aktivoitumisenergian (Ea) käsite, laskenta, merkitys reaktioissa ja käytännön esimerkit selkeästi ja konkreettisesti, jotta kemian ilmiöt avautuvat nopeasti.
Kemiallisen reaktion aktivoitumisenergia on pienin energia, joka tarvitaan reaktion tapahtumiseen. Sen symboli on yleensä Ea ja se mitataan kilojouleina moolia kohti. Sitä voidaan pitää reaktion reagenssien ja tuotteiden välisenä esteenä. Aktivoitumisenergia on siirtymätilan ja lähtöreagenssien välinen energiaero.
Mitä aktivoitumisenergia käytännössä tarkoittaa?
Kuvittele, että reagointi vastaa pienen mäen ylittämistä: vaikka lopputila (tuotteet) olisi matalammalla (energeettisesti suotuisampi), reagenssien täytyy ensin saada riittävästi energiaa nouseakseen mäen huipulle (siirtymätilaan). Aktivoitumisenergia määrittää, kuinka suuri tämä "nousu" on. Jos Ea on pienempi, suurempi osa molekyyleistä pystyy ylittämään esteen tietyssä lämpötilassa, ja reaktio nopeutuu.
Vaikutus reaktion nopeuteen ja lämpötilariippuvuus
Aktivoitumisenergia liittyy suoraan reaktion nopeusvakioon Arrheniuksen yhtälön kautta:
k = A · exp(−Ea / (R·T))
missä k on nopeusvakio, A on esieksponentiaalinen tekijä (törmäystiheys ja orientaatio), R on yleiskaasu, ja T on lämpötila kelvineinä. Yhtälöstä näkyy, että suurempi Ea johtaa pienempään k:hon samalla lämpötilalla, eli hitaampaan reaktioon. Lämpötilan kasvu lisää eksponentin arvoa ja siten merkittävästi reaktion nopeutta, etenkin reaktioissa, joilla on suuri Ea.
Mittaaminen ja määritys
Usein aktivoitumisenergia määretään mittaamalla nopeusvakio k eri lämpötiloissa ja piirtämällä Arrhenius-kuvaaja: ln k vastaan 1/T. Kuvaajan suora lineaarinen sovitus antaa kulmakertoimen −Ea/R, josta Ea voidaan laskea. Toinen tapa on käyttää siirtymätilateoriaa ja tutkia vapautuvaa tai sitoutuvaa entalpiaa sekä vapautuvaa vapaaenergiaa (ΔH‡, ΔG‡), joilla on yhteys aktivoitumisenergiaan.
Esimerkkejä ja tyypilliset suuruusluokat
- Monet ionivälitteiset tai hyvin eksotermiset reaktiot voivat olla vähäenergisiä, Ea 0–40 kJ/mol, ja tapahtua nopeasti huoneenlämmössä.
- Paljon energiaa vaativat kovalenttisten sidosten katkeamiset voivat olla 100–400 kJ/mol luokkaa, jolloin reaktio on hitaampi ilman lisäenergiaa tai katalyyttiä.
- Esimerkki: vetyperoksidin (H₂O₂) hajoaminen on ilman katalyyttiä hitaampaa kuin katalysoituna, koska katalyytit alentavat aktivoitumisenergiaa ja helpottavat siirtymätilan muodostumista.
Katalyytit ja entsyymit
Katalyytit toimivat alentamalla aktivoitumisenergiaa, eivät muuttamalla reaktion kokonaisenergiaeroa. Tämä tarkoittaa, että tasapainoasema (tuotteiden ja reagenssien suhteellinen energia) ei muutu, mutta reaktiosarja etenee nopeammin. Entsyymit ovat biologisia katalyytteja, jotka voivat laskea Ea merkittävästi ja mahdollistaa reaktiot, jotka ilman entsyymiä olisivat käytännössä hidastuneita tai tarvitset hyvin korkean lämpötilan.
Siirtymätila ja termodynamiikka
Siirtymätila (transition state) on reaktion korkein energiataso reaktiokoordinaatilla. Aktivoitumisenergia on energiaero lähtöreagenssien ja tämän siirtymätilan välillä. Termodynaamisesti tärkeä luku on myös vapaan energian muutos ΔG° reaktion lähtökohdan ja lopputilan välillä, joka määrää reaktion suuntaa ja tasapainoa — ero näiden käsitteiden välillä on se, että Ea liittyy nopeuteen ja ΔG° siihen, onko reaktio energisesti suotuisa.
Yhteenveto
- Aktivoitumisenergia Ea on reaktion käynnistämiseksi vaadittu energiahypähdys siirtymätilaan.
- Pienempi Ea tarkoittaa nopeampaa reaktiota samalla lämpötilalla; korkea Ea hidastaa reaktiota.
- Katalyytit alentavat Ea ja nopeuttavat reaktiota vaikuttamatta tasapainotilaan.
- Ea voidaan määrittää käytännössä Arrhenius-kuvaajalla mittaamalla reaktion nopeuksia eri lämpötiloissa.
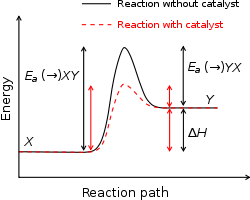
Aktivoitumisenergia katalyytin kanssa ja ilman katalyyttiä
Arrheniuksen yhtälö
Tämä yhtälö on tapa laskea aktivoitumisenergia. Sen muoto on:
k = A e - E a / R T {\displaystyle k=Ae^{{-E_{a}}/{RT}}}}
Tässä k on reaktion nopeusvakio (joka voidaan mitata kemiallisen kinetiikan avulla), A on taajuuskerroin, R on yleinen kaasuvakio ja T on lämpötila. Jos mittaamme, kuinka nopeasti reaktio etenee eri lämpötiloissa, voimme tehdä kuvaajan ja laskea aktivoitumisenergian tämän yhtälön avulla.
Katalyysi
Kun käytetään katalyyttiä, aktivoitumisenergia pienenee. Tämä tarkoittaa, että reaktio voi tapahtua nopeammin samassa lämpötilassa. Katalyytti ei muuta reagenssien tai tuotteiden energiaa. Katalyytti ei myöskään muutu reaktiossa. Siksi sitä voidaan käyttää yhä uudelleen ja uudelleen, ja katalyyttiä tarvitaan vain pieni määrä.
Etsiä
