Kemiallinen kinetiikka | tutkii, kuinka nopeasti kemialliset reaktiot etenevät
Kemiallinen kinetiikka, jota kutsutaan myös reaktiokinetiikaksi, tutkii, kuinka nopeasti kemialliset reaktiot etenevät. Tähän sisältyy sen tutkiminen, miten eri olosuhteet, kuten lämpötila, paine tai käytetty liuotin, vaikuttavat reaktion nopeuteen. Kemiallisen kinetiikan avulla voidaan myös selvittää reaktiomekanismeja ja siirtymätiloja.
Kemiallisen kinetiikan perusajatusta kutsutaan törmäysteoriaksi. Sen mukaan molekyylien on törmättävä toisiinsa, jotta reaktio voisi tapahtua. Jos reaktion nopeutta voidaan lisätä, osumien määrän on siis kasvettava. Tämä voidaan tehdä monin tavoin.
Kokeiden avulla voidaan laskea reaktionopeuksia, joista saadaan nopeuslait ja nopeusvakiot. Nopeuslaki on matemaattinen lauseke, jonka avulla voidaan laskea reaktion nopeus reagenssien konsentraation perusteella.
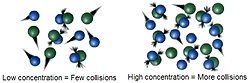
Suuremmassa pitoisuudessa molekyylit osuvat toisiinsa helpommin, joten reaktion nopeus on suurempi.
Reaktion järjestys
tasapaino on luonteeltaan dynaaminen
Tariffilakeja on monenlaisia, mutta yleisimmät niistä ovat:
- nollajärjestysreaktio: nopeus ei riipu pitoisuudesta.
- ensimmäisen kertaluvun reaktio: nopeus riippuu vain yhden reagoivan aineen konsentraatiosta.
- toisen kertaluvun reaktio: nopeus riippuu kahden reagoivan aineen konsentraatiosta tai yhden reagoivan aineen konsentraation neliöstä.
Näiden tietojen perusteella voidaan pohtia reaktion mekanismia. Jos se on esimerkiksi toisen kertaluvun reaktio, on todennäköistä, että reaktion molemmat molekyylit yhdistyvät nopeutta määrittävän vaiheen aikana. Tämä on mekanismin vaikein vaihe, koska siinä on suurin aktivoitumisenergia.
| Nukleofiilinen substituutio | Yksimolekyylinen nukleofiilinen substituutio (SN 1) - Bimolekyylinen nukleofiilinen substituutio (SN 2) - Nukleofiilinen aromaattinen substituutio (SN Ar) - Nukleofiilinen sisäinen substituutio (SN i) |
| Yksimolekyylinen eliminaatio (E1) - E1cB eliminaatioreaktio - Bimolekyylinen eliminaatio (E2). | |
| Elektrofiilinen additio - Nukleofiilinen additio - Vapaaradikaalinen additio - Sykloadditio | |
| Aiheeseen liittyvät aiheet | Alkeisreaktio - Molekyylit - Stereokemia - Katalyysi - Törmäysteoria - Liuotinvaikutukset - Nuolen työntäminen |
| Kemiallinen kinetiikka | |
Kysymyksiä ja vastauksia
K: Mitä on kemiallinen kinetiikka?
V: Kemiallinen kinetiikka, jota kutsutaan myös reaktiokinetiikaksi, on tutkimusta siitä, kuinka nopeasti kemialliset reaktiot etenevät ja kuinka erilaiset olosuhteet, kuten lämpötila, paine tai käytetty liuotin, vaikuttavat reaktion nopeuteen.
K: Mitä todetaan törmäysteoriassa?
V: Törmäysteorian mukaan molekyylien on törmättävä toisiinsa, jotta reaktio voisi tapahtua. Jos reaktion nopeutta voidaan lisätä, osumien määrän on siis kasvettava.
K: Miten reaktionopeudet voidaan laskea?
V: Kokeiden avulla voidaan laskea reaktionopeuksia, joista saadaan nopeuslait ja nopeusvakiot.
K: Mikä on nopeuslaki?
V: Nopeuslaki on matemaattinen lauseke, jonka avulla voidaan laskea reaktion nopeus reagenssien konsentraation perusteella.
K: Miten reaktion nopeutta voidaan lisätä?
V: Reaktion nopeutta voidaan lisätä lisäämällä molekyylien välisten törmäysten määrää. Tämä voidaan tehdä monella tavalla, kuten muuttamalla lämpötilaa, painetta tai käytettyä liuotinta.
K: Mitä ovat siirtymätilat?
V: Siirtymätilat ovat kemiallisten reaktioiden välivaiheita, jotka syntyvät, kun reaktantit muodostavat tuotteita ja energiaa vapautuu tai absorboituu tämän prosessin aikana.
Etsiä