Siirtymätila
Kemiallisessa reaktiossa siirtymätila on piste, jossa energian arvo on suurin. Tätä energiaa kutsutaan aktivoitumisenergiaksi. Kun kaksi tai useampi molekyyli sekoittuu, ne osuvat toisiinsa. Jos ne osuvat toisiinsa riittävän suurella energialla siirtymätilan läpi, ne reagoivat ja muodostavat uusia molekyylejä. Siirtymätilassa muodostuu uusia sidoksia, kun taas vanhat sidokset katkeavat. Kuvaajassa tai piirroksessa siirtymätila merkitään usein kaksoistikarilla ‡-symbolilla.
Siirtymätilaa on hyvin vaikea tutkia. Tämä johtuu siitä, että sen energia on niin suuri, että molekyylit pysyvät siinä muodossa hyvin lyhyen aikaa, yleensä femtosekuntia. On tärkeää, että siirtymätiloja ei sekoiteta välitiloihin. Välitilat löytyvät energian minimipisteistä, ja ne voivat elää hyvin pitkään. Siirtymätilan tavoin välitila on kuitenkin reaktion reagenssien ja tuotteiden välissä.
Siirtymätilojen tutkiminen on erittäin tärkeää reaktiomekanismien ymmärtämiseksi. On olemassa teorioita ja tietokoneohjelmia, joiden avulla voidaan laskea, miltä siirtymätila näyttää. Tämä on osa kemiallista kinetiikkaa.
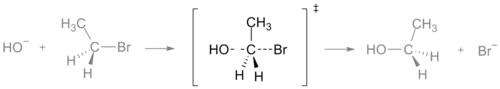
SN2-reaktion siirtymätila
Kysymyksiä ja vastauksia
K: Mikä on kemiallisen reaktion siirtymätila?
A: Siirtymätila on piste, jossa kemiallisessa reaktiossa on energian maksimiarvo.
K: Mikä on aktivoitumisenergia kemiallisessa reaktiossa?
V: Energiaa, joka tarvitaan reaktion tapahtumiseen, kutsutaan aktivoitumisenergiaksi.
K: Mitä tapahtuu, kun kaksi tai useampi molekyyli sekoittuu kemiallisessa reaktiossa?
V: Kun kaksi tai useampi molekyyli sekoittuu, ne osuvat toisiinsa. Jos ne osuvat toisiinsa riittävän suurella energialla siirtymätilan läpi, ne reagoivat ja muodostavat uusia molekyylejä.
K: Mihin kemiallisen reaktion kuvaajassa tai piirroksessa käytetään tuplatikarin (‡) symbolia?
V: Kaksoistikari (‡) -symbolia käytetään merkitsemään siirtymätilaa kemiallisen reaktion kuvaajassa tai piirroksessa.
K: Miksi kemiallisen reaktion siirtymätilan tutkiminen on vaikeaa?
V: Siirtymätilan tutkiminen kemiallisessa reaktiossa on hyvin vaikeaa, koska sen energia on niin suuri, että molekyylit pysyvät siinä muodossa hyvin lyhyen aikaa, yleensä femtosekuntia.
K: Mikä on kemiallisen reaktion välitila?
V: Välitila on molekyyli, joka esiintyy kemiallisen reaktion energian minimipisteissä ja joka voi elää hyvin pitkään.
K: Miksi siirtymätilojen tutkiminen on tärkeää reaktiomekanismien ymmärtämisessä?
V: Siirtymätilojen tutkiminen on tärkeää reaktiomekanismien ymmärtämisessä, koska se auttaa määrittämään, miten reaktio tapahtuu ja miten sitä voidaan hallita tai manipuloida.
Etsiä