Ligandi (biokemia): Määritelmä, sitoutuminen, affiniteetti ja esimerkit
Ligandi (biokemia): selkeä määritelmä, sitoutumisen mekanismit, affiniteetin merkitys ja havainnolliset esimerkit — ymmärrä ligandien rooli soluissa.
Ligandi on biokemiallinen aine. Sen tehtävänä on sitoutua biologiseen molekyyliin ja saada molekyyli suorittamaan jokin tehtävä. Ligandin sitoutuminen muuttaa reseptoriproteiinin muotoa. Tämä muuttaa proteiinin käyttäytymistä.
Suppeammassa merkityksessä se on signaalin laukaiseva molekyyli, joka sitoutuu kohdeproteiinin tiettyyn kohtaan.
Sitoutuminen tapahtuu molekyylien välisten voimien, kuten ionisidosten, vetysidosten ja van der Waalsin voimien avulla. Kytkeytyminen (assosiaatio) on yleensä palautuvaa (dissosiaatio).
Ligandeihin kuuluvat substraatit, inhibiittorit, aktivaattorit ja välittäjäaineet. Sitoutumisen taipumusta tai voimakkuutta kutsutaan affiniteetiksi.
Mitä ligandi tarkoittaa käytännössä?
Ligandi voi olla pieni molekyyli, ioni, peptidi tai suurempi proteiini. Ligandit toimivat monin eri tavoin: ne voivat toimia substraatteina entsyymeille, välittää signaalia reseptoreille, estää entsyymejä tai muuttaa proteiinien aktiivisuutta. Ligandit voivat olla myös lääkeaineita, hormoneja tai hermovälittäjäaineita.
Sitoutumisen mekanismit
Ligandien ja kohdemolekyylien välinen sitoutuminen perustuu useisiin fysikaalisiin vuorovaikutuksiin:
- Ionisidokset (elektrostaattiset vetovoimat)
- Vetysidokset
- Hydrofobiset vuorovaikutukset (vesiä syrjäyttävät pinnat)
- van der Waalsin voimat
- Kovalenttinen sitoutuminen (harvinaisempi; usein pysyvä, esim. jotkin irreversiibelit lääkeaineet)
Ligandin ja proteiinin välinen sitoutuminen voi seurata erilaisia mallisuuntia, kuten lock-and-key-mallia tai induced fit- ja conformational selection-periaatteita, joissa proteiini muuttaa muotoaan ligandin sitoutuessa tai valitsee jo olemassa olevan konformaation.
Affiniteetti, spesifisyys ja aviditeetti
Affiniteetti kuvaa, kuinka vahvasti ligandi sitoutuu kohteeseensa. Yleinen numeerinen mitta on tasapainovakio Kd (dissosiaatiovakio), jossa pienempi Kd tarkoittaa suurempaa affiniteettia. Kd ilmaistaan molaarisina (M). Tyypilliset arvot vaihtelevat millimolaari- eli mM-tasosta erittäin voimakkaisiin piko- tai femtomolaarisiin (pM–fM) arvoihin riippuen systeemistä.
Affiniteetin käänteisarvo on assosiaatiovakio Ka (Ka = 1/Kd). Kinetiikassa käytetään usein assosiaation (kon) ja dissosiaation (koff) nopeusvakioita, joiden suhteena Kd = koff / kon.
Spesifisyys tarkoittaa, kuinka selektiivinen ligandi on tietylle kohteelle suhteessa muihin mahdollisiin kohteisiin. Aviditeetti kuvaa moniarvoisten eli multivalenttisten vuorovaikutusten kokonaistehoa (esim. immunoglobuliinien useat sitoutumiskohdat).
Kinetiikka ja yhteistyö (kooperatiivisuus)
Sitoutumisen kinetiikka määrittää, kuinka nopeasti ligandi sitoutuu ja irtoaa (kon ja koff). Nämä määräävät sekä reagoinnin nopeuden että tasapainon. Joissain järjestelmissä esiintyy kooperatiivisuutta: yhden ligandiosoitteen sitoutuminen muuttaa muiden osotteiden affiniteettia (esim. hemoglobiinin hapen sitoutuminen on positiivisesti kooperatiivista). Kooperatiivisuutta kuvataan usein Hillin kertoimella.
Allosteria ja ortosterinen sitoutuminen
Ligandit voivat sitoutua ortosteriseen kohtaan (aktiivinen kohta) tai allosteriseen kohtaan (toissijainen säätelevä kohta), jolloin allosteerinen ligandi muuttaa proteiinin rakennetta ja siten vaikuttaa toisen ligandin sitoutumiseen tai toimintaan. Allosteeriset modulaattorit voivat olla positiivisia (lisäävät toimintaa) tai negatiivisia (vähentävät toimintaa).
Esimerkkejä ligandeista
- Oksigeni (O2) hemoglobiinissa — pieni kaasumainen ligandi, näyttää kooperatiivisuuden periaatteen.
- Välittäjäaineet kuten asetyylikoliini, dopamiini ja serotoniini — sitoutuvat reseptoreihin hermosoluissa.
- Hormonit, esim. insuliini — proteiini- tai peptidiligandeja, jotka aktivoivat solunsisäisiä signaalireittejä.
- Substraatit entsyymeille, esim. glukoosi hexokinaasille.
- Inhibiittorit ja lääkeaineet, esim. opioidiantagonisti naloksoni tai entsyymi-inhibiittori kuten asetylasetyylisalisyylihapon (aspiriinin) vaikutus COX-proteiineihin (kovalenttinen asetylointi).
Miten affiniteettia ja sitoutumista mitataan?
Yleisimmät menetelmät affiniteetin ja vuorovaikutusten mittaamiseen:
- Radioligand binding -assayt
- Surface plasmon resonance (SPR) — antaa sekä kon että koff
- Isothermal titration calorimetry (ITC) — mittaa lämmönmuutokset ja antaa Kd sekä entalpiamuutoksen
- Fluoresenssiaanisotropia, microscale thermophoresis (MST), biolayer interferometry (BLI)
- Laskennallinen dockkaus ja molekyylidynamiikka ennusteina
Farmakologiassa käytetään myös arvoja kuten IC50 (puolittava inhibitiopitoisuus) ja EC50 (puolittava effektipitoisuus) kuvaamaan vaikutuksen voimakkuutta lääkkeen konsentraatiosta.
Fysiologinen ja farmakologinen merkitys
Ligandien sitoutuminen ohjaa lähes kaikkia solun toimintoja: solujen välistä viestintää, aineenvaihduntaa, geeniekspressiota ja immuunivasteita. Lääketieteessä ligandien affinities ja spesifisyyden optimointi on keskeistä lääkkeiden suunnittelussa — pyritään korkeaan affiniteettiin ja hyvään selektiivisyyteen minimoiden sivuvaikutukset.
Yhteenveto
Ligandi on molekyyli, joka sitoutuu toiseen molekyyliin ja muuttaa sen toimintaa. Sitoutuminen perustuu useisiin fysikaalisiin voimiin ja voi olla reversiibeliä tai irreversiibeliä. Affiniteetti ja kinetiikka kuvaavat sitoutumisen vahvuutta ja nopeutta, ja näitä mitataan erilaisin kokeellisin ja laskennallisin menetelmin. Ligandien tutkimus on keskeistä biokemiassa, solubiologiassa ja lääketutkimuksessa.
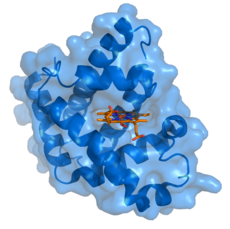
Myoglobiini (sininen) ja sen ligandi hemi (oranssi) sitoutuneena.
Aiheeseen liittyvät sivut
- Signaalin siirto
- Sytokiini
- Agonisti
- Reseptoriantagonisti
Kysymyksiä ja vastauksia
K: Mikä on nivelside?
V: Ligandi on biokemiallinen aine, joka sitoutuu biologiseen molekyyliin saadakseen sen suorittamaan jonkin toiminnon.
K: Miten ligandin sitoutuminen vaikuttaa reseptoriproteiiniin?
V: Ligandin sitoutuminen muuttaa reseptoriproteiinin muotoa, mikä puolestaan muuttaa proteiinin käyttäytymistä.
K: Miten ligandin sitoutuminen tapahtuu?
V: Ligandin sitoutuminen tapahtuu molekyylien välisten voimien, kuten ionisidosten, vetysidosten ja van der Waalsin voimien avulla.
K: Onko ligandin sitoutuminen palautuvaa?
V: Kyllä, ligandin sitoutuminen on yleensä palautuvaa ja se voidaan dissosioida.
K: Mitkä ovat esimerkkejä ligandeista?
V: Ligandeja ovat esimerkiksi substraatit, inhibiittorit, aktivaattorit ja välittäjäaineet.
K: Mitä kutsutaan sitoutumisen taipumukseksi tai vahvuudeksi?
V: Sitoutumisen taipumusta tai voimakkuutta kutsutaan affiniteetiksi.
K: Mikä on ligandin erityinen tehtävä suhteessa kohdeproteiineihin?
V: Suppeammassa merkityksessä ligandi on signaalia laukaiseva molekyyli, joka sitoutuu tiettyyn kohtaan kohdeproteiinissa.
Etsiä