Termokemia: termodynamiikka, entalpia ja reaktioenergia selitetty
Termokemia: selkeä opas termodynamiikkaan, entalpiaan ja reaktioenergian laskentaan — ymmärrä endotermiset ja eksotermiset reaktiot, entropia ja vapaa energia käytännössä.
Lämpökemia tutkii kemiallisiin reaktioihin ja fysikaalisiin muutoksiin (fysikaalisiin muutoksiin) liittyvää energiaa ja lämpöä. Fysikaalisilla muutoksilla tarkoitetaan sitä, että aineen olomuoto (esimerkiksi kiinteä tai nestemäinen aine) muuttuu toiseen olomuotoon. Esimerkkejä muutoksista ovat sulaminen (kun kiinteä aine muuttuu nesteeksi) ja kiehuminen (kun neste muuttuu kaasuksi).
Reaktio luovuttaa tai ottaa energiaa. Myös fysikaalinen muutos luovuttaa tai ottaa energiaa. Lämpökemiassa tarkastellaan näitä energiamuutoksia ja erityisesti systeemin energianvaihtoa ympäristönsä kanssa. Lämpökemian avulla voidaan ennustaa reaktanttien ja tuotteiden määriä kaikkina aikoina tietyn reaktion aikana. Termokemian tutkijat tekevät tämän käyttämällä tietoja, kuten entropian määrityksiä. Termokemistit kertovat, onko reaktio spontaani vai ei-spontaani, suotuisa vai epäsuotuisa.
Endotermiset reaktiot sitovat lämpöä. Eksotermiset reaktiot luovuttavat lämpöä. Termokemiassa yhdistyvät termodynamiikan käsitteet ja kemiallisten sidosten muodossa olevan energian käsite. Se sisältää laskelmia sellaisista suureista kuin lämpökapasiteetti, palamislämpö, muodostumislämpö, entalpia, entropia, vapaa energia ja kalorit.
Termodynamiikka ja entalpia
Termodynamiikka tarjoaa säännöt ja suureet, joilla kuvataan energian ja lämmön kulkua systeemeissä. Keskeinen suure lämpökemiassa on entalpia (H), joka kuvaa systeemin sisäenergian ja siihen liitetyn tilatyön summan. Reaktion entalpiamuutos merkitään ΔH ja kertoo, kuinka paljon lämpöä siirtyy systeemiin tai sieltä ympäristöön vakionpaineessa:
- ΔH < 0: reaktio on eksoterminen (luovuttaa lämpöä).
- ΔH > 0: reaktio on endoterminen (sitoutuu lämpöä).
Usein käytetään standardientalpiaa (ΔH°), joka tarkoittaa entalpiamuutosta aineiden ollessa standarditiloissa (yleensä 1 bar ja 25 °C). Muodostumislämpö (ΔHf°) on entalpiamuutos, kun 1 mol ainetta muodostuu alkuaineistaan standarditiloissa — tästä muodostuvat taulukot, joita käytetään reaktioenthalpioiden laskemiseen.
Entropia ja vapaa energia
Entropia (S) on termodynamiikassa suuruus, joka kuvaa systeemin epäjärjestyksen tai tilojen lukumäärän kasvua. Entropian muutos yhdistettynä entalpian muutokseen antaa Gibbsin vapaan energian muutoksen:
ΔG = ΔH − TΔS
Tässä T on lämpötila kelvineinä. Gibbsin vapaa energia määrää reaktion spontaanisuuden vakio-olosuhteissa: ΔG < 0 merkitsee spontaanista reaktiota, ΔG > 0 ei-spontaania ja ΔG = 0 tasapainotilaa.
Mittaaminen ja laskeminen
Lämpökemialliset suureet mitataan usein kalorimetrialla. Tyypillinen menetelmä on lämpöeristetyssä kalorimetrissä mitata jäähdyttäjän tai ympäristön lämpötilan muutos ja laskea siitä systeemin lämmönvaihto, käyttäen aineen lämpökapasiteettia (c) tai kalorimetrin kalibrointiarvoa.
Entalpiamuutoksia voi laskea kolmella tavallisesti käytetyllä tavalla:
- Suoralla mittauksella kalorimetrilla (esim. palamislämpö tai neutraatiolämmön mittaus).
- Hessin lain avulla: entalpiamuutos reaktiolle on tuotteiden muodostumisentalpioiden summa miinus reaktanttien muodostumisentalpiat. Tämä mahdollistaa ΔH laskemisen eri reiteille jakamalla reaktio tunnetuiksi osareaktioiksi.
- Sidosten murtumisentalpian summauksella: arvioitaessa kaasumaisissa reaktioissa sidosten rikkomiseen kuluneen ja muodostuneiden sidosten vapauttaman energian erotusta.
Yksiköt ja merkinnät
Yleisin yksikkö lämpökemialle on joulit (J) tai kilojoulit per mooli (kJ·mol−1). Historiallisesti on myös käytetty kaloria (cal), mutta SI-yksikkö on joule. Merkitseminen noudattaa yleensä konventiota, jossa lämpöä systeemin vastaanottamana pidetään positiivisena ja luovuttamana negatiivisena vakionpaine-entalpiaa tulkittaessa.
Käytännön esimerkkejä ja sovelluksia
- Polttoaineiden palaminen: Palamislämpö (entalpia) kertoo, kuinka paljon energiaa saadaan poltettaessa tietty määrä polttoainetta — tärkeää energiatuotannossa ja moottoritekniikassa.
- Faasinmuutokset: Sulamisen, höyrystymisen ja sublimaation lämpö (latenttilämpö) ovat entalpian muutoksia, jotka on otettava huomioon prosessilaskelmissa.
- Elektrokemia ja akut: Reaktion Gibbsin vapaa energia liittyy sähkökemialliseen potentiaaliin ja siten akkujen jännitteeseen ja hyötysuhteeseen.
- Teolliset prosessit: Termokemia ohjaa lämmönsalkua, lämmönvaihtoa ja reaktorien suunnittelua kemianteollisuudessa.
Yhteenveto
Lämpökemia (termokemia) yhdistää termodynamiikan peruskäsitteet energian, entalpian ja entropian kanssa. Se antaa välineet arvioida ja mitata, luovuttaako vai sitooko reaktio energiaa, kuinka reaktiot etenevät eri lämpötiloissa ja ovatko ne spontaanisia. Käytännössä termokemia on välttämätöntä energianhallinnassa, kemiallisessa valmistuksessa, ympäristökemiallisissa arvioissa ja monissa arkipäivän teknisissä sovelluksissa.
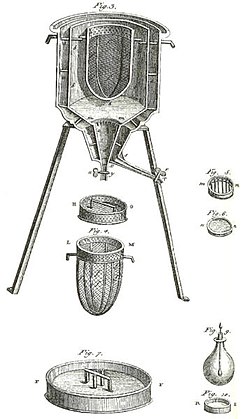
Maailman ensimmäinen jääkalorimetri, jota Antoine Lavoisier ja Pierre-Simon Laplace käyttivät talvella 1782-83. Sitä käytettiin erilaisten kemiallisten muutosten yhteydessä kehittyvän lämmön määrittämiseen. Nämä laskelmat perustuivat Joseph Blackin aiemmin tekemään latentin lämmön löytöön. Nämä kokeet olivat lämpökemian alku.
Historia
Lämpökemia alkoi kahdesta ajatuksesta:
- Lavoisier ja Laplacen laki (1780): Loislacein laki: Minkä tahansa muutoksen energiamuutos on yhtä suuri ja vastakkainen kuin käänteisen prosessin energiamuutos.
- Hessin laki (1840): Hessin laki: Minkä tahansa muutoksen energiamuutos on sama riippumatta siitä, tapahtuuko muutos yhdessä vai useammassa vaiheessa.
Nämä löydöt tehtiin ennen termodynamiikan ensimmäistä lakia (1845). Ne auttoivat tutkijoita ymmärtämään tätä lakia.
Edward Diaz ja Hess tutkivat ominaislämpöä ja latenttia lämpöä. Joseph Black kehitti käsitteen latentti energiamuutos.
Gustav Kirchhoff osoitti vuonna 1858, että reaktiolämmön muutos saadaan tuotteiden ja reagoivien aineiden lämpökapasiteetin erotuksena: ∂ Δ H ∂ T = Δ C p {\displaystyle {\partial \Delta H} \over \partial T}=\Delta C_{p}} 
Kalorimetria
Lämmönmuutosten mittaamista kutsutaan kalorimetriaksi. Sillä mitataan kemiallisten reaktioiden tai fysikaalisten muutosten lämpöä. Kalorimetri eli kalorimetrialaite on yleensä suljettu kammio.
Kalorimetriassa on seuraavat vaiheet: Kemistit saavat muutoksen tapahtumaan kammion sisällä. Kammion lämpötila mitataan joko lämpömittarilla tai termoparilla. Lämpötila piirretään ajan suhteen, jolloin saadaan kuvaaja. Kemistit käyttävät kuvaajaa laskeakseen perussuureita.
Nykyaikaisissa kalorimetreissä on pienet tietokoneet, jotka mittaavat lämpötilan ja antavat lasketut tiedot nopeasti. Yksi esimerkki on DSC-kalorimetri (differential scanning calorimeter).
Järjestelmät
Useat termodynaamiset määritelmät ovat erittäin hyödyllisiä termokemiassa. "Systeemi" on maailmankaikkeuden tietty osa, jota tutkitaan. Kaikkea järjestelmän ulkopuolella olevaa pidetään ympäristönä tai ympäristönä. Systeemi voi olla:
- eristetty järjestelmä - kun se ei voi vaihtaa energiaa tai ainetta ympäristön kanssa, kuten eristetty pommikalorimetri;
- suljettu järjestelmä - kun se voi vaihtaa energiaa mutta ei ainetta ympäristön kanssa, kuten höyrypatteri;
- avoin järjestelmä - kun se voi vaihtaa sekä ainetta että energiaa ympäristönsä kanssa, esimerkiksi kattilan kiehuvan veden kanssa.
Prosessit
Systeemi käy läpi "prosessin", kun yksi tai useampi sen ominaisuuksista (ominaisuuksista) muuttuu. Prosessi liittyy (kytkeytyy) tilan muutokseen. Isoterminen (samassa lämpötilassa tapahtuva) prosessi tapahtuu, kun systeemin lämpötila pysyy samana. Isobaarinen (sama paine) prosessi tapahtuu, kun järjestelmän paine pysyy samana. Adiabaattinen (ei lämmönvaihtoa) prosessi tapahtuu, kun lämpö ei liiku.
Aiheeseen liittyvät sivut
- Tärkeitä termokemian julkaisuja
- Isodesminen reaktio
- Maksimityön periaate
- Reaktiokalorimetri
- Thomsen-Berthelot-periaate
- Julius Thomsen
- Puhtaiden aineiden termodynaamiset tietokannat
- Kalorimetria
- Lämpöfysiikka
Kysymyksiä ja vastauksia
Q: Mitä termokemia on?
V: Termokemia on kemiallisiin reaktioihin ja fysikaalisiin muunnoksiin liittyvän energian ja lämmön tutkimusta.
K: Mitkä ovat esimerkkejä fysikaalisista muunnoksista?
V: Esimerkkejä fysikaalisista muutoksista ovat sulaminen (kun kiinteä aine muuttuu nesteeksi) ja kiehuminen (kun neste muuttuu nesteeksi).
K: Miten termokemia auttaa ennustamaan reagoivien aineiden ja tuotteiden määriä?
V: Termokemistit käyttävät tietoja, mukaan lukien entropian määrityksiä, ennustamaan reaktio- ja tuotemääriä aina tietyn reaktion aikana.
K: Ovatko endotermiset reaktiot suotuisia vai epäsuotuisia?
V: Endotermiset reaktiot ovat epäedullisia.
K: Ovatko eksotermiset reaktiot suotuisia vai epäsuotuisia?
V: Eksotermiset reaktiot ovat suotuisia.
K: Mitä käsitteitä termokemia yhdistää?
V: Termokemiassa yhdistyvät termodynamiikan käsitteet ja kemiallisten sidosten muodossa olevan energian käsite.
K: Minkälaisia laskelmia termokemistit tekevät?
V: Termokemistit tekevät laskelmia, kuten lämpökapasiteetti, palamislämpö, muodostumislämpö, entalpia, entropia, vapaa energia ja kalorit.
Etsiä