Reaktiomekanismi: vaiheittainen määritelmä, välituotteet ja esimerkit
Reaktiomekanismi: vaiheittainen selitys, välituotteet ja siirtymätilat käytännön esimerkein — opi orgaanisen kemian nukleofiiliset substituutiot, eliminaatiot ja additiot.
Reaktiomekanismi on kemiallisen reaktion vaiheittainen kuvaus. Yleensä reaktiossa voidaan nähdä vain kokonaismuutos. Välissä tapahtuvat asiat reagoivat liian nopeasti, jotta ne voitaisiin nähdä. Näitä kutsutaan välituotteiksi, ja siirryttäessä välituotteesta toiseen ylitetään siirtymätila. On kuitenkin tärkeää ymmärtää kaikki vaiheet, jotka muodostavat kokonaismuutoksen. Näin voidaan ymmärtää vaikeampia reaktioita tai yrittää saada reaktio toimimaan tietyllä tavalla.
Reaktiomekanismeja on monenlaisia. Orgaanisessa kemiassa yleisimpiä ovat nukleofiilinen substituutio, eliminaatio ja additio. Ihmiset käyttävät joskus nuolinäppäimiä piirtääkseen, miten elektronit liikkuvat reaktion aikana. Näin on helppo nähdä, mitkä sidokset muodostuvat ja mitkä katkeavat prosessin aikana.
Peruskäsitteet
Reaktiomekanismi koostuu elementaarisista vaiheista, joista kukin kuvaa yhtä yksinkertaista atomien ja elektronien järjestelyn muutosta. Tärkeimpiä käsitteitä ovat:
- Välituote: lyhytikäinen, usein havaittavissa oleva kemiallinen laji (esim. karbokationi, radikaali, karbaani), joka on reaktion keskivaiheilla.
- Siirtymätila: hyvin lyhytkestoinen geometria ja energiatila, jonka ylittämiseen tarvitaan aktivaatioenergia; siirtymätilaa ei voi suoraan isoloida.
- Rajoittava vaihe (rate-determining step): mekanismin hitaimmin tapahtuva vaihe, joka määrää reaktion kokonaisnopeuden.
- Nuoli- tai elektroninsiirtopiirrokset: kaaviossa käytetyt kaarevat nuolet näyttävät elektroniparien liikettä; radikaalireaktioissa käytetään yksikärkisiä nuolia.
Energiaprofiilit ja Hammondin postulaatti
Energiaselvitys (reaktion potentiaalienergia kuvaajana) osoittaa piikit siirtymätiloille ja laakson välituotteille. Aktivaatioenergia on siirtymätilan ja lähtöaineiden välinen energiahypähdys. Hammondin postulaatin mukaan eksotermisen vaiheen siirtymätila muistuttaa enemmän lähtöainetta ja endoteermisen vaiheen siirtymätila muistuttaa enemmän tuotetta — tämä auttaa ennustamaan siirtymätilan luonnetta ja reaktioväylän ominaisuuksia.
Tyypillisiä mekanismeja ja esimerkit
- SN1 (nukleofiilinen substituutio, unimolekulaarinen): vaiheittainen mekanismi, jossa lähtöaineen halkaisu muodostaa ensin karbokationin (välituote) ja tämän jälkeen karbokationia hyökkää nukleofiili. Tyypillinen esimerkki on tert-butyylikloridin hydrolyysi veteen. Ominaisuuksia: reaktionopeus riippuu ainoastaan lähtöaineen konsentraatiosta, ja karbokationin vuoksi usein racemisointi stereokemiallisesti.
- SN2 (bimolekulaarinen nukleofiilinen substituutio): kerralla tapahtuva takaikkunahyökkäys, jossa nukleofiili syrjäyttää lähtöryhmän ja inversion of configuration (Walden-inversio) tapahtuu stereokemiallisesti. Nopeus riippuu sekä lähtöaineen että nukleofiilin konsentraatioista. Esim. metyylibromidin reaktio hydroksidin kanssa.
- E1 ja E2 (eliminaatiot): E1 on kaksivaiheinen (karbokationin kautta), E2 on yhden vaiheen, konsertinen poisto, jossa protoni ja lähtöryhmä poistuvat samanaikaisesti. E2:n stereospesifinen vaatimus on usein anti-periplanaarinen orientaatio alkeisen prooton ja lähtevä ryhmän välillä.
- Elektrofiilinen additio: alkeeniin liittyy ensin elektrofiilin lisäys, usein karbokationivälituote (tai bromonium-jonen kautta muodostuva välituote), jonka jälkeen nukleofiili liittyy.
- Radikaaliketjureaktiot: kuten metaanin kloorointi; koostuu initiaatio (radikaalien muodostus), propagaation (radikaalien välittämiä askelia) ja terminaatioon (radikaalien yhtyminen) vaiheista.
- Pericyclic-reaktiot: concerted-tyyppisiä reaktioita (esim. Diels–Alder), joissa sidosten muodostus ja katkeaminen tapahtuvat samanaikaisesti ilman erillisiä välituotteita.
Konkreettinen esimerkki: SN1 vs SN2
Vertailun vuoksi:
- SN1: 2-butyylikloridi tietyssä liuoksessa → ensin muodostuu 2-butyylikarbokationi, sitten vesi hyökkää ja muodostuu alkoholi. Tuotteessa voi näkyä racemisaatiota, koska karbokationi on planarinen.
- SN2: 2-bromobutaanin primäärinen tai metyylikemiallinen vastine (mikäli substratti on sterically unhindered) → hydroksidi hyökkää takaviistosta ja aiheuttaa stereoinversion.
Mekanismin määrittämisen menetelmiä
Reaktiomekanismin selvittämiseen käytetään useita kokeellisia ja laskennallisia työkaluja:
- Kinetiikka: reaktion nopeuslaki (rate law) kertoo, mitkä aineet osallistuvat rajoittavaan vaiheeseen.
- Stereokemialliset havainnot: säilyykö konfiguratio vai invertoituuko se — tämä erottaa konsertiset ja vaiheittaiset mekanismit.
- Isotooppimerkintä ja kinetiikka-isotooppiefekti: deuterium- tai 18O-merkintä voi paljastaa, mikä sidos murtuu rajoittavassa vaiheessa.
- Intermediattien sieppaus ja spectroskopia: välituotteita voidaan todentaa matalassa lämpötilassa, käyttämällä NMR:ää, IR:ää, massaspektrometriaa tai stop-flow -tekniikoita.
- Liukenevuus- ja solventtivaikutukset: polaariset protiset vs. aprotiset liuottimet vaikuttavat esimerkiksi SN1- vs SN2-reaktioihin.
- Laskennalliset menetelmät: kvanttimekaaniset laskelmat auttavat arvioimaan siirtymätilojen energiaa ja ennustamaan reittien todennäköisyyksiä.
Katalyysi ja entsyymit
Katalyytit muuttavat reaktiopolkua alentamalla siirtymätilan energiaa tai tarjoamalla vaihtoehtoisen reitin. Entsyymit käyttävät useita keinoja: läheisyyden ja suuntauksen optimointi, yleinen happo-emäs -katalyysi, kovalenttinen välivaiheen muodostus ja ennen kaikkea transitiotilan stabilointi. Näin reaktionopeudet voivat kasvaa miljoonia kertoja.
Merkitys käytännössä
Reaktiomekanismin ymmärtäminen auttaa kemistia suunnittelemaan reittejä, ennustamaan sivutuotteita, parantamaan selektiivisyyttä ja kehittämään tehokkaita katalyytteja. Mekanismin tuntemus on myös välttämätöntä turvallisuuden, ympäristövaikutusten ja teollisen toteutettavuuden arvioinnissa.
Yhteenvetona: reaktiomekanismi paljastaa, miten atomeja ja elektroneja liikutetaan askel askeleelta. Mekanismin selvittäminen yhdistää kokeellisen havainnon, stereokemian, kinetiikan ja laskennalliset mallit muodostaen kokonaisuuden, jonka avulla kemiallisia reaktioita voidaan ennustaa ja ohjata.
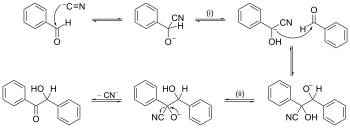
Esimerkki reaktiomekanismista, jossa nuoli työntää nuolta.
Kysymyksiä ja vastauksia
K: Mikä on reaktiomekanismi?
A: Reaktiomekanismi on vaiheittainen selitys siitä, miten kemiallinen reaktio toimii.
K: Miksi on tärkeää ymmärtää kaikki reaktiomekanismin vaiheet?
V: On tärkeää ymmärtää kaikki reaktiomekanismin vaiheet, jos haluaa ymmärtää vaikeita reaktioita tai yrittää saada reaktion toimimaan tietyllä tavalla.
K: Mitä ovat kemiallisen reaktion välituotteet?
V: Välituotteet ovat asioita, jotka syntyvät välissä reagoivat liian nopeasti, jotta ne näkyisivät kemiallisessa reaktiossa.
K: Mikä on kemiallisen reaktion siirtymätila?
V: Siirtymätila on kemiallisen reaktion aikana yhdestä välituotteesta toiseen siirtyminen.
K: Mitkä ovat yleisimmät reaktiomekanismit orgaanisessa kemiassa?
V: Yleisimmät reaktiomekanismit orgaanisessa kemiassa ovat nukleofiilinen substituutio, eliminaatio ja additio.
K: Mikä on nuolen työntäminen kemiallisessa reaktiomekanismissa?
V: Nuolen työntämistä käytetään joskus piirtämään, miten elektronit liikkuvat reaktion aikana. Näin on helppo nähdä, mitkä sidokset muodostuvat ja mitkä katkeavat prosessin aikana.
K: Mitä tietoa voidaan saada ymmärtämällä reaktiomekanismia?
V: Reaktiomekanismin ymmärtäminen voi antaa tietoa siitä, miten reaktio saadaan toimimaan haluamallasi tavalla, tai auttaa ymmärtämään vaikeampia reaktioita.
Etsiä