Isolobaalianalogia (isolobaaliperiaate) – määritelmä ja merkitys organometallikemiassa
Isolobaalianalogia (isolobaaliperiaate) selitetty: merkitys organometallikemiassa, käytännön esimerkit, Hoffmannin Nobel-työ ja reaktiivisuuden ennustaminen.
Isolobaaliperiaate (tunnetaan myös nimellä isolobaalianalogia) on tapa ennustaa metalliorgaanisten yhdisteiden sidosominaisuuksia ja reaktiivisuutta. Organometallien kemiassa se liittyy sellaisten orgaanisten ligandien rakenteeseen, jotka voivat sitoutua epäorgaanisiin molekyylifragmentteihin. Roald Hoffmann kuvasi molekyylifragmentteja isolobaalisiksi, "jos rajaorbitaalien lukumäärä, symmetriaominaisuudet, likimääräinen energia ja muoto sekä niissä olevien elektronien lukumäärä ovat samankaltaisia - eivät identtisiä, mutta samankaltaisia". Vähemmän tunnetun kappaleen sitoutumista ja reaktiivisuutta voidaan ennustaa paremmin tunnetun kappaleen sitoutumisesta ja reaktiivisuudesta, jos kahdella molekyylifragmentilla on samanlaiset rajapintaorbitaalit, korkeimmin miehitetty molekyyliorbitaali (HOMO) ja alhaisin miehittämätön molekyyliorbitaali (LUMO). Isolobaaliset yhdisteet ovat analogeja isoelektronisille yhdisteille, joilla on sama valenssielektronien määrä ja rakenne. Kuvassa 1 on graafinen esitys isolobaalirakenteista, joissa isolobaaliparit on yhdistetty kaksipäisellä nuolella, jonka alapuolella on puoli orbitaalia.
Määritelmä ja periaatteet
Isolobaalianalogian ydinajatus on vertailla molekyylifragmenttien rajapintaorbitaaleja (frontier orbitals). Tärkeimmät vertailtavat ominaisuudet ovat:
- Rajaorbitaalien lukumäärä (esim. kuinka monta puoli-orbitaalia on käytettävissä sitoutumiseen),
- Oribitaalien symmetria (soveltuvatko ne samaan sitoutumiseen),
- Oribitaalien energia ja muoto (onko energiaspektri ja muoto yhteensopiva),
- Elektronien lukumäärä kyseisissä rajapintaorbitaaleissa.
Kun kaksi fragmenttia ovat isolobaalisia, niiden odotetaan muodostavan vastaavia sidoksia ja reagoivan samankaltaisesti, vaikka atomikoostumus ja kokonaisrakenne voivat olla erilaisia. Isolobaalisuus ei tarkoita täydellistä identtisyyttä vaan funktionaalista ja orbitaalista vastaavuutta.
Käytännön esimerkkejä ja sovellukset
Isolobaalianalogia on hyödyllinen apuväline, kun halutaan:
- ennustaa metallifragmentin ja orgaanisen ligandin välistä sidosta,
- muuntaa tunnettuja orgaanisia rakenteita organometallisiksi analogeiksi suunnittelun ja synteesin apuna,
- selittää ja rationalisoida katalyyttisiä mekanismeja sekä ligandinvaihtoa ja hapetusasteen vaikutuksia,
- liittää elektronilaskentaa (esim. 18-elektronin sääntö) ja orbitaalianalyysi kemialliseen intuitioon.
Esimerkinomaisesti karbo- tai alkyliradikaalin ja tietyn metallifragmentin välillä voi olla isolobaalinen suhde siten, että kummallakin on yksi puoli-orbitaali ja yksi epäpari-elektroni. Tällöin metallifragmentti voi käyttäytyä orgaanisen radikaalin kaltaisesti sitoumuksessa tai reaktioissa. Samoin karbeeni (R2C:) ja joidenkin metallifragmenttien kaksielektroniset rajapintaorbitaalit voivat olla funktionaalisesti vastaavia, mikä auttaa ymmärtämään karbeeni-tyyppisiä reaktiivisia keskuksia organometallisissa järjestelmissä.
Rajoitukset ja varoitukset
Hoffmannille myönnettiin vuonna 1981 Nobelin kemianpalkinto hänen työstään isolobaalianalogian parissa, jonka hän jakoi Kenichi Fukuin kanssa. Nobel-palkintoluennossaan Hoffmann korosti, että isolobaalinen analogia on hyödyllinen mutta yksinkertainen malli. Se epäonnistuu tietyissä tapauksissa, ja käyttäjän tulee olla tietoinen sen rajoituksista:
- Isolobaalisuus huomioi pääosin orbitaalien topologian ja elektronimäärän, mutta ei aina ota riittävästi huomioon energioiden eroja, elektronikonfiguraation hienorakennetta tai d-orbitaalien erityispiirteitä.
- Malli ei huomioi steriikkaa, pitkäkantaisia vuorovaikutuksia tai liiallisen yksinkertaistamisen takia esiintyviä poikkeuksia (esim. merkittävä π-backbonding tai heteroatomien sähkönegatiivisuusmuutokset).
- Relativistiset vaikutukset ja moni-elektronivaikutukset voivat tehdä isolobaalianalogian ennusteista epätarkkoja raskaille alkuaineille.
Käytännön neuvot tutkijoille ja opiskelijoille
Kun käytät isolobaalista analogiaa:
- yhdistä se kvanttikemialliseen laskentaan tai spektroskooppisiin tietoihin varmentaaksesi orbitaalien energiat ja muodot,
- käytä sitä heuristina uusien rakenneosien suunnittelussa, mutta tarkista synteettiset ja termodynaamiset näkökohdat kokeellisesti,
- muista, että isolobaalianalogia toimii parhaiten, kun verrattavat fragmentit ovat samanlaisen elektronikonfiguraation ja symmetrian piirissä.
Yhteenvetona: isolobaaliperiaate on voimakas ja intuitiivinen työkalu organometallikemian ajattelussa: se yhdistää orbitaalianalyysin kemialliseen intuitioon ja auttaa ennustamaan sidoksia ja reaktiviteettia. Malli ei kuitenkaan korvaa yksityiskohtaista laskentaa tai kokeellista vahvistusta, ja sen rajoitukset tulee pitää mielessä sovelluksissa.
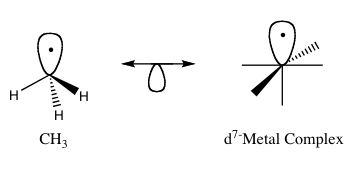
Kuva 1: Perusesimerkki isolobaalisesta analogiasta.
Kysymyksiä ja vastauksia
K: Mikä on isolobaaliperiaate?
V: Isolobaaliperiaate (tunnetaan myös nimellä isolobaalianalogia) on tapa ennustaa metalliorgaanisten yhdisteiden sidosominaisuuksia. Se suhteuttaa sellaisten orgaanisten ligandien rakenteen, jotka voivat sitoutua epäorgaanisiin molekyylifragmentteihin, vertaamalla niiden korkeimmin miehitettyä molekyyliorbitaalia (HOMO) ja alinta miehittämätöntä molekyyliorbitaalia (LUMO).
K: Kuka ehdotti isolobaaliperiaatetta?
V: Roald Hoffmann ehdotti isolobaaliperiaatetta.
K: Miten se liittyy isoelektronisiin yhdisteisiin?
V: Isolobaaliset yhdisteet ovat isoelektronisten yhdisteiden analogeja, joilla on sama valenssielektronien lukumäärä ja rakenne.
K: Mitä Hoffmann sai tätä käsitettä koskevasta työstään?
V: Hoffmannille myönnettiin isolobaalianalogiaa koskevasta työstään Nobelin kemianpalkinto vuonna 1981, jonka hän jakoi Kenichi Fukuin kanssa.
K: Miten Hoffmann kuvasi molekyylipalasia?
V: Hoffmann kuvasi molekyylifragmentteja isolobaalisiksi, "jos rajapinnan orbitaalien lukumäärä, symmetriaominaisuudet, likimääräinen energia ja muoto sekä niissä olevien elektronien lukumäärä ovat samankaltaisia - eivät identtisiä, mutta samankaltaisia".
Kysymys: Miten tätä mallia voidaan käyttää sidosten ja reaktiivisuuden ennustamiseen?
V: Voidaan ennustaa vähemmän tunnettujen kappaleiden sitoutumista ja reaktiivisuutta paremmin tunnettujen kappaleiden sitoutumisesta ja reaktiivisuudesta, jos niillä on samanlaiset rajaorbitaalit.
K: Toimiiko tämä malli aina oikein?
V: Ei, se epäonnistuu tietyissä tapauksissa.
Etsiä