Histologinen värjäys mikroskopiassa – solujen ja kudosten värjäystekniikat
Histologinen värjäys mikroskopiassa — opas solujen ja kudosten värjäystekniikoihin, kontrastin parantamiseen, väriaineiden käyttöön ja diagnostiikkaan.
Värjäystä käytetään mikroskopiassa, jotta solut ja kudokset olisivat helpommin nähtävissä ja ymmärrettävissä.
Näin parannetaan mikroskooppisen kuvan kontrastia. Väriaineita käytetään usein biologiassa ja lääketieteessä korostamaan rakenteita biologisissa kudoksissa, usein erilaisten mikroskooppien avulla.
Värjäys voidaan tehdä eläville kudoksille (in vivo) tai kuolleille kudoksille (in vitro).
Miksi värjätään?
Useimmat biologiset kudokset ovat läpinäkyviä tai heikosti kontrastisia kirkkaassa valossa. Värjäyksen avulla voidaan:
- Korostaa rakenteita, kuten tumaa, solukalvoa, lihassäikeitä tai kollageenia.
- Erottaa solutyyppejä ja tunnistaa esimerkiksi tulehdussoluja, bakteereja tai syöpäsoluja.
- Mahdollistaa kohdennetun havaitsemisen käyttämällä spesifisiä väriaineita tai antigeeneihin kohdistuvia vasta-aineita (immunovärjäys).
- Parantaa kuvan analysointia niin manuaalisesti kuin automaattisilla kuvantamisalgoritmeilla.
Yleisimmät värjäystekniikat
- Hematoksiliini–eosiini (H&E) – yleisin histologinen värjäys: hematoksiliini värjää tumat sinipunaisiksi ja eosiini sytoplasman vaaleanpunaiseksi.
- Gram-värjäys – bakteerien luokitteluun gram-positiivisiin ja gram-negatiivisiin.
- PAS (Periodic acid–Schiff) – glykogeenin ja sokeripitoisten komponenttien havaitsemiseen.
- Special-värjäykset (esim. Masson, Silver, Ziehl–Neelsen) – kollageenin, hermasäikeiden tai mykobakteerien visualisointiin.
- Immunohistokemia (IHC) – spesifisten proteiinien paikantamiseen käyttäen merkittyjä vasta-aineita.
- Fluorokromivärjäys – DAPI nukleiinihappojen merkitsemiseen, calcein ja propidiumiodidi solujen elinvoimaisuuden testaamiseen sekä erilaiset fluoresoivat vasta-aineet (FITC, AlexaFluor).
- Elektronimikroskopian varjostus – esimerkiksi osmiumtetroksidi, uranyyliasetaatti ja lyijykitraatti tuottavat kontrastia sähkömikroskopiassa.
Värjäyksen perusvaiheet
Histologinen värjäys sisältää yleensä seuraavat vaiheet:
- Fiksointi – kudoksen säilyttäminen ja proteiinien stabilointi (esim. formaldehydi, paraformaldehydi, glutaraaldehydi).
- Upotus ja leikkaus – parafiini- tai jäädytys-upotus ja ohuet leikkeleet (mikrotomi tai cryostat).
- Deparaffinointi ja uudelleenhydratointi – parafiinileikkeiden valmistelu vesivärjäystä varten.
- Värjäys – pääväriaineen ja vastavärin/erityiskäsittelyjen soveltaminen.
- Pesu ja dehydrataatio – ylimääräisen väriaineen poisto ja leikkeen kuivaus.
- Peittäminen – peitepeitin ja liima (mounting) pitkäaikaissäilytystä ja mikroskopointia varten.
Elävät vs. kuolleet näytteet
Elävät solut voidaan värjätä vitaleilla väreillä (esim. Trypan blue, neutral red, calcein‑AM) solun elinkelpoisuuden ja funktion seuraamiseksi. Näissä menetelmissä väriaineet eivät yleensä tapa soluja tai ne poistuvat solusta ajan myötä. Joitain fluoresoivia probeja käytetään solujen sisäisten prosessien seuraamiseen elävässä solussa.
Kuolleet näytteet (fixatut) sallivat laajemman väriaineiden ja entsyymikäsittelyjen käytön, kuten IHC ja erityisvärjäykset. Fixaatio voi kuitenkin muuttaa epitoppejä, jolloin tarvitaan antigen retrieval -käsittelyjä IHC:ssä.
Fluoresenssivärjäys ja immunohistokemia
Fluoresenssitekniikat tarjoavat korkean herkkyyden ja mahdollistavat useiden merkintöjen samanaikaisen havaitsemisen eri aallonpituuksilla. Immunohistokemiassa käytetään spesifisiä vasta-aineita, joita voidaan merkitä entsymaattisilla reagensseilla (esim. HRP) tai fluoroforeilla. Tärkeitä huomioita:
- Käytä asianmukaisia positiivisia ja negatiivisia kontrollinäytteitä.
- Estä ei-spesifinen sitoutuminen käyttämällä blocking‑liuoksia.
- Varo fotobleachingia—säilytä fluoresoivat näytteet pimeässä ja käytä peitepeitinvahaa, joka sisältää anti‑fade‑komponentteja.
Elektronimikroskopia
Elektronimikroskopiassa kontrastia lisätään raskasmetallivarjostuksella (esim. osmiumtetraoksidi lipideille, uranyyli ja lyijy proteiineille). Näytteen valmistus on tarkkaa ja vaatii huolellisen fiksaation, dehydraation ja upotuksen resiinissä.
Yleisiä käytännön vinkkejä ja virheiden välttäminen
- Valmistele ja merkitse näytteet huolellisesti virheiden välttämiseksi.
- Noudata valmistajan ohjeita väriaineiden pitoisuuksista ja inkubaatioajoista—ylivärjäys ja alivärjäys vaikuttavat tulkintaan.
- Huolehdi työturvallisuudesta: monet väriaineet ja fiksaatioreagenssit ovat myrkyllisiä tai haitallisia.
- Dokumentoi ja säilytä kontrollit samassa sarjassa kuin näytteet luotettavuuden varmistamiseksi.
- Vältä kontaminaatiota ja saostumaa huolellisella liuosten valmistuksella ja sekoittamisella.
Sovellukset
Histologista värjäystä käytetään laajasti diagnostiikassa (patologia), tutkimuksessa (solubiologia, kehitysbiologia), mikrobiologiassa (bakteerien tunnistus) ja opinnoissa. Oikein valittu ja suoritettu värjäys paljastaa rakenteet ja muutokset, jotka auttavat diagnosoimaan tauteja, ymmärtämään solutoimintoja ja kehittämään uusia hoitomuotoja.
Yhteenveto
Värjäystekniikat ovat keskeinen osa mikroskopiaa. Valinta riippuu tutkittavasta rakenteesta, käytettävästä mikroskoopista ja tutkimuksen tavoitteista. Hyvin suunniteltu värjäysmenetelmä yhdessä asianmukaisten kontrollien kanssa antaa luotettavia ja tulkittavia tuloksia.
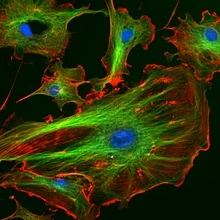
Huippuluokan mikroskooppi: Ytimet värjätään siniseksi DAPI:llä, mikrotuplat merkitään vihreällä vasta-aineella ja aktiinifilamentit punaiseksi falloidiinilla.

Tyypillinen mikroskooppiasetelma. Värjätty näyte lasisella mikroskooppilevyllä kiinnitetään mikroskoopin alustalle.
Valmistelu
Kuollut kudos on "kiinnitettävä", jotta se ei hajoa. Kiinnitysaine pitää rakenteen ennallaan. Kiinnittämisen jälkeen kudos voidaan leikata ohuiksi viipaleiksi ja asettaa lasisille mikroskooppilevyille. Toisinaan on tarpeen liuottaa solukalvoja, jotta suuret väriainemolekyylit pääsevät soluihin. Standardit julkaistaan Biotechnic & Histochemistry -lehdessä.
Värjäys
Yksinkertaisin tapa on kastaa dia ja näyte väriaineliuokseen, huuhdella se ja tutkia. Käytetyt väriaineet ovat sertifioituja väriaineita, jotka on testattu Biological Stain Commission -järjestössä.
Bakteerien värjäys
Gram-värjäystä käytetään bakteerien luokitteluun. Se perustuu niiden soluseinän koostumukseen. Gram-värjäyksessä käytetään kristalliviolettia soluseinien värjäämiseen, jodia peittausaineena ja vastavärjäystä, joka merkitsee kaikki bakteerit.
Grampositiiviset bakteerit värjäytyvät tummansiniseksi tai violetiksi. Niiden soluseinästä puuttuu gramnegatiivisten bakteerien sekundaarinen kalvo ja lipopolysakkaridikerros.
Useimmissa gramvärjättyjen preparaattien gramnegatiiviset organismit ovat punaisia tai vaaleanpunaisia vastavärjäyksestä.
Kudosten värjäys
Hematoksyliini- ja eosiinivärjäystä käytetään usein histologiassa ohuiden kudosleikkeiden värjäykseen. Hematoksyliini värjää solujen tumat siniseksi, kun taas eosiini värjää sytoplasman, sidekudoksen ja muut solunulkoiset aineet vaaleanpunaiseksi tai punaiseksi.
Eosiini imeytyy voimakkaasti punasoluihin ja värjää ne kirkkaan punaisiksi. Taitavasti tehdyssä H&E-valmisteessa punasolut ovat lähes oransseja, ja kollageeni ja sytoplasma (erityisesti lihakset) ovat vaaleanpunaisen eri sävyisiä. Hematoksyliini värjää solun tuman ja muut happamat rakenteet (kuten sytoplasman RNA-rikkaat osat ja hyaliiniruston matriisi) siniseksi. Eosiini sen sijaan värjää sytoplasman ja kollageenin vaaleanpunaiseksi.
Nopea ja yksinkertainen värjäys, jota käytetään verinäytteissä ja ihmisen poskisoluissa, on metyleenisininen, joka värjää ytimet. On olemassa monia muita erikoisvärjäyksiä, joista jotkut fluoresoivat erityisvalossa.
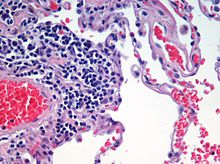
Mikroskooppikuva ihmisen keuhkokudoksen histologisesta näytteestä, joka on värjätty hematoksyliinillä ja eosiinilla.
Etsiä