Sulfoksidit – kemian määritelmä, rakenne, ominaisuudet ja DMSO
Sulfoksidit: kemian määritelmä, rakenne ja ominaisuudet. Tutustu dimetyylisulfoksidiin (DMSO), kiraalisuuteen, tetraedriseen rikkirakenteeseen ja käyttöihin liuottimena.
Sulfoksidi on molekyyli, jossa rikkiatomi on sitoutunut kahteen hiileen ja yhteen happiatomiin. Se syntyy hapettamalla tioeettereitä menemättä sulfoniin asti. Kuten monet muutkin rikkiä sisältävät molekyylit, sulfoksidi voi joskus haista hyvälle.
Sulfoksidit voidaan kirjoittaa yleiskaavalla R-S(=O)-R'. Rikki on kaksoissidoksessa hapen kanssa ja yksinkertaisessa sidoksessa hiilien kanssa. Näin ollen atomiin jää yksinäinen pari. Tämä tarkoittaa, että kyseisen atomin muoto on tetraedrinen. Se tarkoittaa myös, että rikki voi olla kiraalinen keskus. Sulfoksideja käytetään hyvinä ligandeina siirtymämetalleille.
Tärkeä tällainen molekyyli on dimetyylisulfoksidi. Sitä kutsutaan myös nimellä DMSO. Sitä käytetään liuottimena monissa reaktioissa, erityisesti biokemiassa.
Rakenne ja stereokemia
Sulfoksidin perusrakenne on R–S(=O)–R'. S-lähestyessä happisidos on luonteeltaan π-tyyppinen ja rikkialkion ympärillä on yksi parittomaksi kuvattu elektronipari, jolloin S on sp3-hybridisoitunut ja ympäristö tetraedrinen. Tämän seurauksena rikki voi toimia stereokeskuksena: monet sulfoksidit ovat
- kiraalisia ja niillä voi olla erilliset enantiomeerit,
- sekä joillain yhdisteillä konfiguraatio on riittävän stabiili, jotta erilaisten enantiomeerien erottelu on mahdollista.
Konfiguraation pysyvyys riippuu substituenttien koosta ja elektronisista tekijöistä; suuret ja jännitteiset substituentit hidastavat invertoitumista ja tekevät keskusspesifisyydestä pysyvämmän.
Fysikaaliset ominaisuudet
- Sulfoksidit ovat yleisesti polaarisia molekyylejä; niillä on vahva dipolinen luonne S=O-ryhmän vuoksi.
- Monet sulfoksidit ovat vesiliukoisempia kuin vastaavat thioeetterit.
- Dimetyylisulfoksidi (DMSO, (CH3)2SO) on väritön, korkeapisteinen, veteen sekoittuva liuotin: sen kiehumispiste on noin 189 °C ja sulamispiste noin 18–19 °C, minkä vuoksi se on nestemäinen huoneenlämpötilassa.
Synteesi ja reaktiivisuus
Tyypillinen tapa valmistaa sulfoksideja on tioeetterin (thioetherin) osittainen hapetus. Hapettimina käytetään mm. peroksideja tai järjestettyja hapetusreagensseja siten, että hapetus pysähtyy sulfoxiditasolle eikä jatku sulfoniin asti.
Sulfoksidit reagoivat monin tavoin:
- Ne voidaan hapettaa edelleen sulfoneiksi tietyillä reagensseilla.
- Ne voidaan pelkistää takaisin thioeettereiksi.
- Sulfoksidit osallistuvat erikoisreaktioihin, kuten Pummerer-reagointiin, jolla voidaan funktionalisoida alfahiiliä S=O-ryhmän läheisyydessä.
- Sulfoxidin happi voi koordinoitua metallien kanssa, joten sulfoksidit toimivat usein ligandeina, yleensä O-pään kautta.
DMSO — erityistapaus
Dimetyylisulfoksidi (DMSO) on yksi tunnetuimmista sulfoksideista. Sen ominaisuuksia ja käyttötarkoituksia ovat muun muassa:
- erittäin hyvä polar aprotic -liuotin, joka liuottaa monia orgaanisia ja epäorgaanisia yhdisteitä;
- korkea kiehumispiste tekee siitä käyttökelpoisen korkealämpötilaisissa reaktioissa;
- se on sekoittuva veden kanssa ja sillä on korkea dielektrinen vakio, mikä edistää ionisten reaktioiden tapahtumista;
- kemiallisesti DMSO on myös hyödyllinen reagenssi: sitä käytetään mm. Swern-typen hapetusproseduureissa ja muissa orgaanisissa muunnoksissa;
- biokemiallisissa ja lääketieteellisissä sovelluksissa DMSO toimii usein liuottimena, kantaja-aineena ja cryoprotectanttina (solujen jäädytyksessä käytetty lisäaine, tyypillisesti noin 10 %).
Sovellukset
- Teollisuus- ja laboratoriokemikaalit: sulfoksidit ovat yleisiä liuottimina ja väliainereaktioissa.
- Lääkeaineissa: monissa lääkkeissä esiintyy sulfoxidiryhmä (esim. tiettyjen protonipumpun estäjien rakenteissa), koska ryhmä voi vaikuttaa molekyylin fysikaalisiin ja biologisiin ominaisuuksiin.
- Asymmetrinen synteesi: kiraalisia sulfoksideja käytetään sekä synteesin välituotteina että stereospesifisinä lähtöaineina ja käänteishapetuksissa.
- Koordinaatiokemia: sulfoksidit toimivat ligandeina siirtymämetalleille, usein O-sitoen.
Turvallisuus ja käsittely
DMSO ja monet muut sulfoksidit ovat yleisesti melko turvallisia, mutta niihin liittyy huomioitavia seikkoja:
- DMSO imeytyy helposti ihon läpi ja voi kuljettaa liuenneita aineita verenkiertoon; siksi metallivärin- tai muiden epäpuhtauksien kanssa työskentelyssä on varottava.
- joidenkin sulfoksidien hajua kuvataan valkosipulimaiseksi tai rikkiä muistuttavaksi; hajua ei kuitenkaan aina esiinny voimakkaana.
- työskentelyssä käytetään suojakäsineitä ja -laseja ja riittävää ilmanvaihtoa; avotulen ja erittäin voimakkaiden hapettimien kanssa on oltava varovainen.
Yhteenveto
Sulfoksidit ovat monikäyttöisiä, polaarisia rikkiä sisältäviä orgaanisia yhdisteitä, joiden tunnusmerkkinä on R–S(=O)–R'-rakenne. Ne ovat tärkeitä liuottimia, reaktiivisia välituotteita ja monien biologisesti aktiivisten molekyylien osia. Erityisesti DMSO on laajalti käytetty liuotin ja reagenssi, mutta sen käytössä on huomioitava turvallisuus ja ihon kautta tapahtuva imeytyminen.
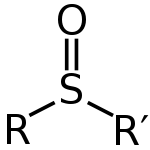
Sulfoksidin yleinen rakenne
Kysymyksiä ja vastauksia
K: Mikä on sulfoksidi?
A: Sulfoksidi on molekyyli, jossa rikkiatomi on sitoutunut kahteen hiileen ja yhteen happiatomiin.
K: Mistä sulfoksidi on peräisin?
V: Sulfoksidi syntyy hapettamalla tioeettereitä menemättä sulfoniin asti.
K: Mikä on sulfoksidien yleiskaava?
V: Sulfoksidien yleinen kaava on R-S(=O)-R'.
K: Mikä on atomin muoto sulfoksideissa?
V: Sulfoksidien atomin muoto on tetraedrinen.
K: Voiko rikki olla kiraalinen keskus sulfoksideissa?
V: Kyllä, sulfoksideissa oleva rikki voi olla kiraalinen keskus.
K: Mikä on dimetyylisulfoksidi ja mihin sitä käytetään?
V: Dimetyylisulfoksidi, joka tunnetaan myös nimellä DMSO, on tärkeä sulfoksidimolekyyli, ja sitä käytetään liuottimena monissa reaktioissa, erityisesti biokemiassa.
K: Miksi sulfoksideja käytetään hyvinä ligandeina siirtymämetalleille?
V: Sulfoksideja käytetään hyvinä ligandeina siirtymämetalleille, koska ne pystyvät koordinoitumaan metalli-ionien kanssa rikkiatomin elektroniparin ansiosta.
Etsiä