Thomsonin atomimalli eli luumupudding-malli selitys ja historia
Thomsonin atomimalli luumupudding-malli selitys ja historia selkeästi ja kiinnostavasti: teoria, J J Thomsonin löydökset ja miksi malli osoittautui virheelliseksi
Luumupudding-malli oli 1900-luvun alkupuolen (ja virheellinen) atomimalli. Sen ehdotti J.J. Thomson vuonna 1904, elektronin löytämisen jälkeen mutta ennen atomiytimen löytämistä. Tuohon aikaan tiedemiehet tiesivät, että atomissa oli positiivinen varaus, joka tasapainotti elektronien negatiivisia varauksia ja teki atomista neutraalin, mutta he eivät tienneet, mistä positiivinen varaus oli peräisin. Thomsonin malli näytti atomin, jossa oli positiivisesti varautunut väliaine eli avaruus, jonka sisällä oli negatiivisesti varautuneita elektroneja. Pian sen esittämisen jälkeen mallia kutsuttiin "luumupudding-malliksi", koska positiivinen väliaine oli kuin vanukas, jonka sisällä oli elektroneja eli luumuja.
Miksi malli ehdotettiin
1897 J. J. Thomson oli löytänyt elektronin, eli atomien negatiivisen osan. Silloin tiedettiin, että atomit olivat sähköisesti neutraaleja, joten tutkijat olettivat, että atomin positiivinen varaus oli jakautunut jotenkin tasaisesti. Thomson ehdotti vuonna 1904 yksinkertaista, intuitiivista rakennetta: positiivinen "täyte" sisälsi upotettuina erillisiä elektroneja, aivan kuten luumuja vanukaspuddingissa. Malli yritti selittää atomin sähköistä tasapainoa ja kemiallisia ominaisuuksia yksinkertaisella mekanismilla.
Miten malli kuvasi atomia
- Positiivinen tausta: atomin massa ja positiivinen varaus olivat jatkuvana, tasaisesti jakautuneena aineena tai "tahnaa".
- Elektronit: negatiivisesti varautuneet elektronit olivat stationäärisesti upotettuina tähän positiiviseen väliaineeseen.
- Neutraalius: kokonaisuuden varaus oli nolla, koska positiivinen täyte korvasi elektronien negatiivisen varauksen.
Mikä siinä oli hyvää
- Selkeä ja yksinkertainen selitys atomin sähköiselle neutraaliudelle.
- Soveltui ajatukseen, jonka mukaan atomin massan ja varauksen olisi oltava laajalle jakautuneita ennen ytimen löytymistä.
- Tarjosi lähtökohdan jatkotutkimuksille ja herätti keskustelua atomin rakenteesta.
Miksi malli ei kestänyt kokeellista testausta
- Suuret poikkeamat sironnassa: luumupudding-malli ennusti, että nopeiden, raskaitten hiukkasten pitäisi läpäistä atomi lähes ilman suuria suunnanmuutoksia. Kuitenkin kultafolio-kokeessa havaittiin, että osa alfa-hiukkasista kimposi takaisin tai hyvin jyrkästi sivulle.
- Säteilyn ja energian ongelma: klassisen sähködynamiikan mukaan paikallaan olevat tai pyörivät varatut partikkelit säteilisivät jatkuvasti energiaa ja romahtaisivat lopulta positiiviseen massaan — tämä teki atomista epästabiilin luumupudding-mallissa.
- Sähkömagneettinen spektri: mallilla ei voitu selittää atomien tarkkoja emissio- ja absorptiospektrilinjoja, joita esimerkiksi vetyatomissa havaittiin.
- Massan keskittyminen: myöhemmät havainnot osoittivat, että lähes koko atomin massa sijaitsee hyvin pienessä tilassa (ytimessä), ei laajalle levinneessä positiivisessa "väliaineessa".
Rutherfordin kokeet ja luumupuddingin romahdus
Vuonna 1909 Hans Geiger ja Ernest Marsden suorittivat Ernest Rutherfordin johtamana kultafolio-kokeen, jossa alfa-hiukkasten sirontaa tutkittiin ohuen metallifolion läpi. Tulokset olivat yllättäviä: suurin osa hiukkasista kulki suoraan läpi, mutta pieni osa kimposi taaksepäin tai voimakkaasti sivulle. Rutherford tulkitsi nämä tulokset siten, että atomin positiivinen varaus on keskittynyt pieneen, tiheään ytimeen, jonka ympärillä elektronit kiertävät verrattain etäällä. Tämä johti niin sanotun ydinatomin eli Rutherfordin mallin syntyyn (noin 1911) ja korvasi luumupudding-mallin.
Seuraava kehitys
Rutherfordin ydinmalli ratkaisi sirontakysymyksen mutta ei selittänyt atomien spektriviivoja eikä elektronien pysyvyyttä klassisen fysiikan puitteissa. Niels Bohr laajensi atomimallia vuonna 1913 yhdistämällä sen kvanttiajatuksiin: Bohrin malli esitti, että elektronit liikkuvat tietyillä pysyvillä ratoilla ja siirtymät näiden ratojen välillä selittävät valon emittoitumisen ja absorptiolinjat. Myöhemmin moderni kvanttimekaniikka korvasi nämä varhaiset kuvat ja antoi tarkan matemaattisen kuvauksen atomin rakenteesta ja elektronien todennäköisyysjakaumista.
Merkitys ja perintö
- Vaikka luumupudding-malli oli virheellinen, se oli tärkeä välivaihe atomin rakenteen ymmärtämisessä.
- Malli osoittaa, miten tieteelliset teoriat kehittyvät jatkuvasti: yksinkertaisia malleja ehdotetaan, niitä testataan kokeellisesti ja korvataan tarkemmilla kuvauksilla.
- Thomsonin työ elektronin löytämisessä ja mallin esittäminen auttoivat suuntaamaan kokeellista työtä, joka lopulta johti ydinfysiikan ja kvanttimekaniikan syntyyn.
Yhteenveto
Thomsonin luumupudding-malli kuvasi atomia positiivisen "täytteen" sisään upotetuilla elektroneilla. Malli oli luonnollinen reaktio elektronin löydön jälkeen, mutta se ei kestänyt kokeellista testausta, erityisesti Rutherfordin kultafolio-kokeen vuoksi. Mallin hylkääminen johti ydintutkimuksen ja myöhemmin kvanttimekaniikan kehitykseen, jotka muodostavat nykyisen ymmärryksemme atomin rakenteesta.

Esimerkki Thomsonin mallista
Kehitys nykyaikaiseksi atomimalliksi
Rutherfordin malli
Periaatteessa vuonna 1909, vähän sen jälkeen kun Thomsonin malli oli esitetty, Hans Geiger ja Ernest Marsden tekivät kokeen ohuilla kultalevyillä testatakseen Thomsonin mallia. Heidän professorinsa Ernest Rutherford odotti, että tulokset osoittaisivat Thomsonin olevan oikeassa, mutta tulokset poikkesivat suuresti siitä, mitä he odottivat. Vuonna 1911 Rutherford havaitsi, että positiiviset varaukset olivat peräisin pienistä hiukkasista, joita kutsutaan protoneiksi, ja että protonit olivat pienessä keskuksessa, jota kutsutaan ytimeksi, ja että elektronit kiersivät ydintä.
Bohrin malli
Rutherfordin malli oli melko yksinkertainen, mutta se oli väärä, koska elektroneilla on varaus, ja niiden pitäisi vetää puoleensa positiivisesti varautunutta ydintä. Vuonna 1913 Niels Bohr lisäsi atomimalliin "energiatasot". Elektronit eivät putoa ytimeen, koska ne sisältyvät energiatasoihin, ja korkeammille energiatasoille siirtymiseen tarvitaan lisäenergiaa, ja matalammille energiatasoille siirtymiseen tarvitaan energian vapautumista. Energiatiloja ei ole mahdollista vaihtaa muuttamatta elektronin energiaa. Jos elektroniin osuu fotoni (sähkömagneettista säteilyä kuljettava hiukkanen), se saa lisäenergiaa ja siirtyy korkeammalle energiatasolle (se vaihtaa energiatilaa), minkä jälkeen se hyppää takaisin alemmalle energiatasolle vapauttaen sisältämänsä energian. Tätä uutta mallia kutsuttiin Bohrin malliksi tai Rutherford-Bohrin malliksi. Tämä lisäsi kokonaan uuden tieteenalan: Kvanttifysiikka.
Kvanttimalli
Vuonna 1926 Erwin Schrödinger käytti ajatusta, jonka mukaan elektronit toimivat sekä aaltona että hiukkasena, mikä tunnetaan aalto-hiukkasdualismina. Tämä lisäsi atomimalliin ja kvanttifysiikkaan aivan uuden kerroksen. Hiukkasen kohdalla voidaan tietää, missä se on avaruudessa, jos sitä tarkkaillaan (katsotaan). Mutta aallon kohdalla se on kaikkialla, joten et voi määritellä, missä se tarkalleen ottaen on. Tätä kutsutaan kvanttiepävarmuudeksi. Elektronin kohdalla voi tietää vain todennäköisyyden, että se on jossakin paikassa, koska se on sekä aalto että hiukkanen. (Katso yllä oleva kaavio)
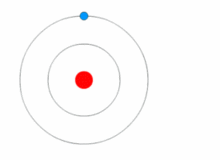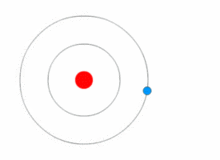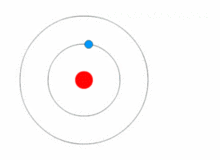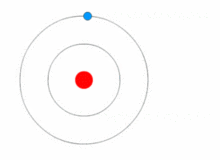
Kuva, jossa elektroni vaihtaa energiatasoa ja saa ja luovuttaa energiaa fotoneina.
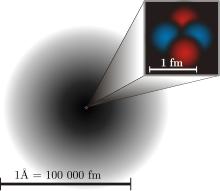
Tämä näyttää nykyisen atomimallin. Musta varjostus atomin ympärillä osoittaa todennäköisyyden, jolla elektroni löytyy atomista. Mitä tummempi se on, sitä todennäköisemmin elektroni löytyy kyseisestä kohdasta.
Aiheeseen liittyvät sivut
- Atomiteoria
- Kvanttimekaniikka
- J. J. Thomson
- Ernest Rutherford
- Niels Bohr
- Erwin Schrödinger
Etsiä