Atomi — aineen perusyksikkö: rakenne, isotoopit ja kemialliset sidokset
Atomi — perusteellinen opas: atomin rakenne, protonit, neutronit, elektronit, isotoopit, alkuaineet ja kemialliset sidokset selkein esimerkein.
Atomi on aineen perusyksikkö. Kaikki tavallinen aine maapallolla ja kaikkialla maailmankaikkeudessa koostuu atomeista. Tähän kuuluvat kiinteät aineet, nesteet ja kaasut. On olemassa tietty määrä erilaisia atomeja, joita kutsutaan kemiallisiksi alkuaineiksi. Atomi on aineen pienin yksikkö, joka voi yhdistyä muiden atomien kanssa muodostaakseen molekyylejä ja monimutkaisempaa ainetta, jolla on erityisiä kemiallisia ominaisuuksia. Atomien kemialliset ominaisuudet määräytyvät pääasiassa niiden elektronirakenteen perusteella.
Atomin rakenne
Atomit koostuvat kolmenlaisista subatomisista hiukkasista. Ne ovat protonit, neutronit ja elektronit. Protonit ja neutronit muodostavat atomin keskellä sijaitsevan, pienen ja hyvin tiheän ytimen. Elektronit liikkuvat ytimen ympärillä elektronipilvenä tai kvanttimekaanisina orbitalleina; ne ovat paljon kevyempiä kuin nukleonit ja ne pitävät atomia koossa vetovoiman avulla. Elektronit vetävät ydintä puoleensa sähkömagneettisella voimalla, koska niillä on vastakkaiset sähkövaraukset verrattuna protoneihin.
Protonien määrä atomin ytimessä määrittää alkuaineen: sama määrä protoneja tarkoittaa samaa kemiallista alkuainetta. Tämä luku tunnetaan myös nimellä järjestysluku. Ydinenergiaan ja massaan vaikuttavat sekä protonit että neutronit; niiden yhteismäärää kutsutaan massaluvuksi. Atomien massa mitataan yleensä atomimassayksiköissä (u) tai relatiivisena atomimassana.
Koko ja mittaaminen
Atomit ovat hyvin pieniä, mutta niiden tarkka koko riippuu niiden tyypistä. Atomien läpimitta on tyypillisesti noin 0,1–0,5 nanometriä. Yksi nanometri on noin 100 000 kertaa pienempi kuin ihmisen hiuksen leveys. Tämän vuoksi yhtä atomia on mahdotonta nähdä paljain silmin; tarkkaa rakennetta tutkitaan erikoislaitteilla ja laskennallisilla malleilla. Tutkijat saavat selville, miten ne toimivat tekemällä kokeita sekä käyttämällä mikroskooppisia menetelmiä, kuten atomivoimamikroskopiaa ja sähkövirtaan perustuvia kuvantamistekniikoita.
Alkuaineet, isotoopit ja ionit
Atomit, joilla on sama määrä protoneja, ovat sama kemiallinen alkuaine ja niillä on hyvin samanlaiset ominaisuudet. Esimerkkejä alkuaineista ovat vety ja kulta. Luonnossa esiintyy noin 92 alkuainetta, joista osa on raskaita alkuaineita; muita on valmistettu keinotekoisesti laboratoriossa.
Atomeilla, joilla on sama määrä protoneja mutta eri määrä neutroneita, on eri isotoopit. Isotoopeilla on usein samanlaiset kemialliset ominaisuudet, mutta niiden massat ja ydinominaisuudet (esim. radioaktiivisuus) voivat poiketa. Jos atomilla on enemmän tai vähemmän elektroneja kuin protoneja, sitä kutsutaan ioniksi, ja sillä on sähkövaraus. Positiivinen ioni (kationi) syntyy, kun elektroni irtoaa; negatiivinen ioni (anion) syntyy, kun atomi ottaa vastaan ylimääräisen elektronin.
Kemialliset sidokset ja molekyylit
Monet aineet koostuvat useammasta kuin yhdestä atomityypistä. Nämä ovat kemiallisia yhdisteitä tai seoksia. Atomit voivat liittyä toisiinsa tekemällä kemiallisia sidoksia. Sidokset syntyvät pääosin elektronien jakamisesta tai siirtymisestä atomien välillä, ja sidosten luonne määrää yhdisteen fysikaaliset ja kemialliset ominaisuudet.
- Kovalenttinen sidos: Atomit jakavat elektroneja molekyylin muodostamiseksi. Esimerkiksi vesimolekyyli koostuu kahdesta vetyatomista ja yhdestä happiatomista; vety- ja happiatomien välillä on kovalenttinen sidos.
- Ionisidos: Tapahtuu, kun yksi atomi luovuttaa elektronin toiselle, ja syntyneet ionit pysyvät toistensa lähellä sähköisten vetovoimien vuoksi (esim. ruokasuola NaCl).
- Metallinen sidos: Metalliatomeille tyypillinen kovat ja sähköä johtavat rakenteet, joissa ulkoelektronit liikkuvat vapaasti atomien välillä.
Molekyyliryhmän sisällä elektronien sijoittuminen ja valenssielektronit (ulkoelektronit) määräävät, kuinka monta sidosta atomi voi muodostaa. Tämä selittää esimerkiksi hiilen neljän sidoksen taipumuksen orgaanisissa yhdisteissä.
Atomien muutos: ydinreaktiot ja radioaktiivisuus
Atomeja syntyy, tuhoutuu tai muuttuu toisenlaisiksi atomeiksi pääasiassa ydinreaktioissa, joissa ytimen rakenne muuttuu. Näitä muutoksia tutkitaan ydinfysiikassa. Radioaktiivisuus on ilmiö, jossa epästabiili ydin hajoaa vapauttaen säteilyä ja muuttaen alkuaineen toiseen isotooppiin tai toiseen alkuaineeseen. Atomit voivat myös yhdistyä suuremmiksi atomeiksi hyvin korkeissa lämpötiloissa, kuten tähden sisällä tapahtuvassa fuusioprosessissa, tai hajota ydinhalkeamisen kautta esimerkiksi ydinreaktoreissa.
Mallien kehitys ja kvanttimekaniikka
Atomin kuvaus on kehittynyt: varhaisista mallista (esim. Daltonin tai Bohrin malli) on siirrytty kvanttimekaaniseen malliin, jossa elektronit eivät kierrä yksinkertaisilla radalla vaan esiintyvät todennäköisyysjakaumina eli orbitaaleina (s-, p-, d-, f-orbitaalit). Kvanttimekaniikka selittää monia atomin ja aineen käyttäytymisen piirteitä, kuten energiatilojen diskreettisyyden ja elektronien täyttymissäännöt (esim. Paulin kieltoperiaate).
Miksi atomit ovat tärkeitä arjessa ja tieteessä
Ymmärtämällä atomien rakennetta ja sidoksia voimme selittää ja hyödyntää kemiallisia reaktioita, valmistaa uusia materiaaleja, kehittää lääkkeitä ja tutkia maailmankaikkeuden toimintaa. Atomit ovat kaiken rakenteen perusta — niiden ominaisuudet vaikuttavat suoraan aineen makro-ominaisuuksiin.
Yhteenvetona: atomit ovat pieniä, monimutkaisia hiukkasrakenteita, joiden protonien määrä määrittää alkuaineen, neutronit vaikuttavat massaan ja stabiliteettiin, ja elektronit hallitsevat kemiallista käyttäytymistä.
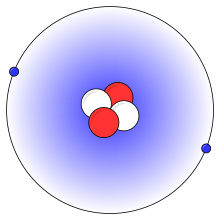
Heliumatomin yksinkertaistettu kuva, jossa on kaksi protonia (punainen), kaksi neutronia (valkoinen) ja kaksi elektronia (sininen).
Historia
Sana "atomi" tulee kreikan (ἀτόμος) sanasta "atomos", jakamaton, sanoista (ἀ)-, ei, ja τόμος, leikkaus. Ensimmäinen henkilö, jonka tiedämme käyttäneen sanaa "atomi", on kreikkalainen filosofi Demokritos noin 400 eaa. Hän uskoi, että kaikki oli tehty atomeista, eikä atomeja voinut hajottaa pienempiin osiin. Atomiteoria oli aluksi filosofinen aihe, eikä sitä juurikaan tutkittu tai tutkittu tieteellisesti, kunnes kemia kehittyi 1650-luvulla.
Vuonna 1777 ranskalainen kemisti Antoine Lavoisier määritteli ensimmäisen kerran termin alkuaine. Hänen mukaansa alkuaine on mikä tahansa perusaine, jota ei voida hajottaa muiksi aineiksi kemian menetelmin. Kaikki aineet, jotka voidaan hajottaa, olivat yhdisteitä.
Vuonna 1803 englantilainen filosofi John Dalton esitti, että alkuaineet koostuvat pienistä, kiinteistä palloista, joita kutsutaan atomeiksi. Dalton uskoi, että kaikilla saman alkuaineen atomeilla on sama massa. Hänen mukaansa yhdisteitä muodostuu, kun useamman kuin yhden alkuaineen atomit yhdistyvät. Daltonin mukaan tietyssä yhdisteessä yhdisteen alkuaineiden atomit yhdistyvät aina samalla tavalla.
Vuonna 1827 brittiläinen tiedemies Robert Brown tarkasteli mikroskoopilla siitepölyjyviä vedessä. Siitepölynjyvät näyttivät heiluvan. Brown käytti Daltonin atomiteoriaa kuvaamaan kuvioita niiden liikkeissä. Tätä kutsuttiin Brownin liikkeeksi. Vuonna 1905 Albert Einstein osoitti matematiikan avulla, että siitepölyhiukkasia liikutti yksittäisten vesimolekyylien liike eli lämpö. Näin hän todisti lopullisesti atomin olemassaolon. Vuonna 1869 venäläinen tiedemies Dmitri Mendelejev julkaisi ensimmäisen version jaksollisesta järjestelmästä. Jaksollinen järjestelmä ryhmittelee alkuaineet niiden järjestysluvun mukaan (kuinka monta protonia niissä on; tämä on yleensä sama kuin elektronien määrä). Samassa sarakkeessa eli jaksossa olevilla alkuaineilla on yleensä samanlaiset ominaisuudet. Esimerkiksi helium, neon, argon, krypton ja ksenon ovat kaikki samassa sarakkeessa, ja niillä on hyvin samanlaiset ominaisuudet. Kaikki nämä alkuaineet ovat kaasuja, joilla ei ole väriä eikä hajua. Ne eivät myöskään pysty yhdistymään muiden atomien kanssa muodostaakseen yhdisteitä. Yhdessä ne tunnetaan jalokaasuina.
Fyysikko J.J. Thomson löysi ensimmäisenä elektronit. Tämä tapahtui hänen työskennellessään katodisäteiden parissa vuonna 1897. Hän huomasi, että niillä oli negatiivinen varaus, ja atomiytimellä oli positiivinen varaus. Thomson laati luumupudding-mallin, jonka mukaan atomi oli kuin luumupudding: kuivatut hedelmät (elektronit) olivat juuttuneet vanukasmassaan (jolla oli positiivinen varaus). Vuonna 1909 tutkija Ernest Rutherford osoitti Geiger-Marsdenin kokeella, että suurin osa atomista on hyvin pienessä tilassa, atomiytimessä. Rutherford otti valokuvauslevyn ja peitti sen kultafoliolla. Sitten hän ampui siihen alfahiukkasia (jotka koostuvat kahdesta yhteen tarttuneesta protonista ja kahdesta neutronista). Monet hiukkasista menivät kultakalvon läpi, mikä osoitti, että atomit ovat enimmäkseen tyhjää tilaa. Elektronit ovat niin pieniä ja nopeasti liikkuvia, että ne eivät estäneet hiukkasia menemästä läpi. Rutherford löysi myöhemmin protoneja ytimestä.
Vuonna 1913 Niels Bohr esitteli Bohrin mallin. Tämä malli osoitti, että elektronit kiertävät ytimen ympärillä kiinteitä ympyränmuotoisia ratoja. Tämä oli tarkempi kuin Rutherfordin malli. Se ei kuitenkaan ollut vielä täysin oikea. Bohrin malliin on tehty parannuksia sen esittelyn jälkeen.
Vuonna 1925 kemisti Frederick Soddy havaitsi, että joillakin jaksollisen järjestelmän alkuaineilla oli useampia kuin yksi atomilaji, joita kutsutaan isotoopeiksi. Soddy uskoi, että alkuaineen isotoopeilla on erilainen massa. Todistaakseen tämän kemisti Francis W. Aston rakensi massaspektrometrin, joka mittaa yksittäisten atomien massan. Aston todisti, että Soddy oli oikeassa. Hän havaitsi myös, että jokaisen atomin massa on kokonaisluku kertaa protonin massa. Tämä tarkoitti, että ytimessä on oltava jokin muu hiukkanen kuin protoni. Vuonna 1932 fyysikko James Chadwick ampui alfahiukkasia berylliumatomiin. Hän näki, että beryllium-atomeista ampui ulos hiukkanen. Tällä hiukkasella ei ollut varausta, mutta sillä oli suunnilleen sama massa kuin protonilla. Hän nimesi hiukkasen neutroniksi.
Toistaiseksi tarkin malli perustuu Schrödingerin yhtälöön. Schrödinger oppi, että elektronit ovat ytimen ympärillä pilvessä, jota kutsutaan elektronipilveksi. Elektronipilvessä on mahdotonta tietää tarkasti, missä elektronit ovat. Schrödingerin yhtälön avulla voidaan määrittää, missä elektroni todennäköisesti on. Tätä aluetta kutsutaan elektronin kiertoradaksi.
Vuonna 1937 saksalainen kemisti Otto Hahn oli ensimmäinen henkilö, joka sai aikaan ydinfission laboratoriossa. Hän havaitsi tämän sattumalta, kun hän ampui neutroneja uraaniatomiin toivoen saavansa aikaan uuden isotoopin. Hän kuitenkin huomasi, että uuden isotoopin sijasta uraani muuttui bariumatomiksi, joka on pienempi atomi kuin uraani. Hahn oli "rikkonut" uraaniatomin. Tämä oli maailman ensimmäinen kirjattu ydinfissioreaktio. Tämä löytö johti lopulta atomipommin ja ydinvoiman luomiseen, jossa fissio tapahtuu toistuvasti, jolloin syntyy ketjureaktio.
Vielä 1900-luvulla fyysikot syvenivät atomin salaisuuksiin. Hiukkaskiihdyttimien avulla he havaitsivat, että protonit ja neutronit koostuivat muista hiukkasista, joita kutsutaan kvarkkeiksi.
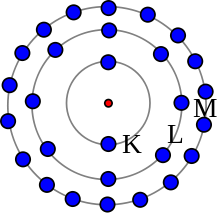
Bohrin malli ei ole tarkka, mutta se on hyödyllinen elektronikuorien idean kannalta. Tässä atomissa on 28 elektronia kolmessa kuoressa.
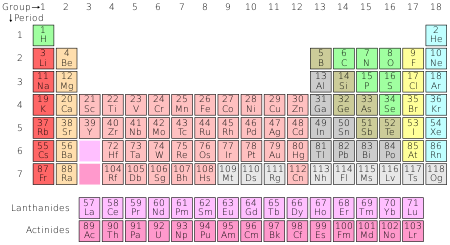
Jaksollinen järjestelmä järjestää kaikki tunnetut kemialliset alkuaineet.

Ernest Rutherford
Luokitus
Atomin sisältämien protonien lukumäärää kutsutaan atomiluvuksi. Saman alkuaineen atomeilla on sama järjestysluku. Esimerkiksi kaikilla hiiliatomeilla on kuusi protonia, joten hiilen järjestysluku on kuusi. Nykyään tunnetaan 118 alkuaineita. Riippuen siitä, miten luku lasketaan, maapallolla esiintyy luonnossa 90-94 alkuainetta. Kaikki numeroa 94 suuremmat alkuaineet ovat vain ihmisen valmistamia. Nämä alkuaineet on järjestetty jaksolliseen järjestelmään.
Koska protonien ja neutronien massa on hyvin samankaltainen ja elektronien massa on hyvin pieni, voimme kutsua atomin protonien ja neutronien lukumäärää massaluvuksi. Useimmilla alkuaineilla on useita isotooppeja, joilla on eri massaluku. Isotoopin nimeämiseksi käytetään alkuaineen nimeä, jota seuraa sen massaluku. Atomi, jossa on kuusi protonia ja seitsemän neutronia, on siis nimeltään hiili-13. Tietyn alkuaineen kaikkien atomien keskimääräistä massaa kutsutaan sen atomimassaksi tai atomipainoksi.
Jos atomin protonit, neutronit tai elektronit vaihdetaan toisiin hiukkasiin, saadaan aikaan eksoottisia atomeja. Kokeet ovat osoittaneet, että jokaisella hiukkasella on vastakohta, jota kutsutaan antihiukkaseksi. Yhdessä nämä hiukkaset muodostavat antiaineen. Antiaineatomi koostuisi antiprotoneista, antineutroneista ja antielektroneista (positroneista). Kun hiukkanen kohtaa antihiukkasensa, molemmat tuhoutuvat. Tätä lukuun ottamatta antiaineatomit voisivat olla hyvin samankaltaisia kuin tavalliset atomit.
Rakenne ja osat
Osat
Atomi koostuu kolmesta päähiukkasesta: protonista, neutronista ja elektronista. Vedyn isotoopissa, vety-1:ssä, ei ole neutroneja, vaan vain yksi protoni ja yksi elektroni. Positiivisessa vetyionissa ei ole elektroneja, vain yksi protoni. Kaikissa muissa atomeissa on kussakin vähintään yksi protoni, yksi neutroni ja yksi elektroni.
Elektronit ovat ylivoimaisesti pienin kolmesta atomihiukkasesta. Niiden koko on liian pieni, jotta niitä voitaisiin mitata nykyisellä tekniikalla, ja niiden massa on noin 9,1 × 10−28 grammaa (0,00055 atomimassayksikköä). Niillä on negatiivinen varaus. Protonit ja neutronit ovat samankokoisia ja -painoisia, ja niiden massa on noin 1,7×10−24 grammaa (1 atomimassayksikkö). Protoneilla on positiivinen varaus, ja neutroneilla ei ole varausta. Useimmilla atomeilla on neutraali varaus. Protonien (positiivisten) ja elektronien (negatiivisten) määrä on sama, joten varaukset tasoittuvat nollaan. Ioneissa (eri määrä elektroneja) näin ei kuitenkaan ole, ja niillä voi olla positiivinen tai negatiivinen varaus. Protonit ja neutronit koostuvat kahdentyyppisistä kvarkkeista: ylös- ja alas-kvarkkeista. Protonissa on kaksi ylöspäin suuntautuvaa kvarkkia ja yksi alaspäin suuntautuva kvarkki, ja neutronissa on kaksi alaspäin suuntautuvaa kvarkkia ja yksi ylöspäin suuntautuva kvarkki.
Nucleus
Ydin on atomin keskellä. Se muodostaa yli 99,9 % atomin massasta. Se on kuitenkin hyvin pieni: noin 1 femtometrin (10−15 m) läpimitta, joka on noin 100 000 kertaa pienempi kuin atomin leveys, joten sen tiheys on hyvin suuri. Se koostuu protoneista ja neutroneista. Yleensä luonnossa kaksi asiaa, joilla on sama varaus, hylkii tai ampuu poispäin toisistaan. Tutkijat eivät siis pitkään aikaan tienneet, miten ytimen positiivisesti varautuneet protonit pysyivät yhdessä. Nyt uskomme, että protonien ja neutronien välinen vetovoima johtuu vahvasta vuorovaikutuksesta.
Vahva vuorovaikutus on voimakkainta hyvin lyhyellä etäisyydellä. Tällä etäisyydellä sitä kuljettaa hiukkanen nimeltä gluoni. Gluonit toimivat kuin liima, joka kiinnittää kvarkit yhteen protonissa tai neutronissa. Pidemmällä etäisyydellä vahva vuorovaikutus on heikompi. Sitä kuljettaa hiukkanen nimeltä mesoni. Mesonit vetävät protoneja ja neutroneita puoleensa vahvan vuorovaikutuksen avulla. Ne pitävät ytimen kasassa. Tätä vahvan vuorovaikutuksen erityistä muotoa kutsutaan ydinvoimaksi.
Neutronien määrä suhteessa protoneihin määrittää, onko ydin vakaa vai hajoaako se radioaktiivisesti. Kun neutroneita tai protoneja on liikaa, atomi pyrkii pienentämään tai tasoittamaan lukumäärää poistamalla ylimääräisiä hiukkasia. Se tekee tämän lähettämällä säteilyä alfa-, beeta- tai gammahajoamisen muodossa. Ytimet voivat muuttua myös muilla tavoin. Ydinfissiossa ydin hajoaa kahdeksi pienemmäksi ytimeksi, jolloin vapautuu paljon energiaa. Tämä energian vapautuminen tekee ydinfissiosta käyttökelpoisen pommien valmistuksessa ja sähkön tuottamisessa ydinvoiman muodossa. Toinen tapa, jolla ytimet voivat muuttua, on ydinfuusio, jolloin kaksi ydintä yhdistyy tai sulautuu suuremmaksi ytimeksi. Tämä prosessi vaatii valtavasti energiaa, jotta protonien välinen sähköstaattinen vastustus voidaan voittaa, koska niillä on sama varaus. Näin suuri energia on yleisintä auringon kaltaisissa tähdissä, joissa vetyä fuusioidaan polttoaineeksi. Kun fuusio kuitenkin tapahtuu, vapautuu paljon enemmän energiaa, koska osa massasta muuttuu energiaksi.
Elektronit
Elektronit kiertävät ydintä eli liikkuvat sen ympärillä. Niitä kutsutaan atomin elektronipilveksi. Sähkömagneettinen voima vetää niitä puoleensa ydintä. Elektroneilla on negatiivinen varaus, ja ytimellä on aina positiivinen varaus, joten ne vetävät toisiaan puoleensa.
Bohrin mallin mukaan jotkin elektronit ovat eri kerroksissa kauempana ytimestä kuin toiset. Näitä kutsutaan elektronikuoriksi. Olemme oppineet, että vain ulomman kuoren elektronit voivat muodostaa kemiallisia sidoksia. Ulomman kuoren elektronien määrä määrittää, onko atomi vakaa tai minkä atomien kanssa se sitoutuu kemiallisessa reaktiossa. Jos atomilla on vain yksi kuori, se tarvitsee kaksi elektronia ollakseen täydellinen. Muussa tapauksessa ulkokuori tarvitsee kahdeksan elektronia ollakseen täydellinen.
Bohrin malli on tärkeä, koska se sisältää ajatuksen energiatasoista. Jokaisessa kuoressa olevilla elektroneilla on tietty määrä energiaa. Ytimestä kauempana olevilla kuorilla on enemmän energiaa. Kun elektroniin osuu pieni energiapurkaus, jota kutsutaan fotoniksi, elektroni voi hypätä korkeamman energian kuoreen. Fotonissa on oltava täsmälleen oikea määrä energiaa, jotta elektroni siirtyy uudelle energiatasolle. Fotoni on valonpurkaus, ja energiamäärä määrää valon värin. Kukin atomityyppi absorboi siis tietyn väristä valoa, jota kutsutaan absorptiospektriksi. Elektroni voi myös lähettää eli emittoida fotonin ja pudota alemmalle energiakuorelle. Vastaavista syistä atomi lähettää vain tiettyjä valon värejä, joita kutsutaan emissiospektriksi.
Kokonaiskuva on monimutkaisempi. Toisin kuin maapallo, joka liikkuu auringon ympäri, elektronit eivät liiku ympyrää pitkin. Emme voi tietää elektronin tarkkaa paikkaa. Tiedämme vain todennäköisyyden eli mahdollisuuden, että se on missä tahansa paikassa. Jokainen elektroni on osa kiertorataa, joka kuvaa, missä se todennäköisesti on. Yhdellä orbitaalilla voi olla korkeintaan kaksi elektronia; näillä kahdella elektronilla on eri spin.
Jokaisella kuorella, joka on numeroitu 1, 2, 3 ja niin edelleen, voi olla useita eri muotoisia orbitaaleja. Orbitaalityypeille annetaan kirjaimet: s, p, d ja f. Yhdelle numero- ja kirjainyhdistelmälle voi myös olla useita orbitaaleja. Kun elektroneja lisätään, ne liittyvät orbitaaleihin järjestyksessä pienimmästä suurimpaan energiaan. Tämä järjestys alkaa seuraavasti: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. Esimerkiksi klooriatomilla on 17 elektronia. Sillä on siis 2 elektronia 1s-orbitaalissa, 2 elektronia 2s-orbitaalissa, 6 elektronia 2p-orbitaalissa, 2 elektronia 3s-orbitaalissa ja 5 elektronia 3p-orbitaalissa. Toisin sanoen sillä on 2 elektronia ensimmäisessä kuoressa, 8 elektronia toisessa kuoressa ja 7 elektronia kolmannessa kuoressa.

Eri orbitaalien muodot atomin ympärillä
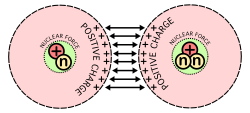
Kuva ydinfuusion suurimmista vaikeuksista: Protonit, joilla on positiivinen varaus, hylkivät toisiaan, kun ne pakotetaan yhteen.
Ominaisuudet
Koko ja massa
Atomin koko riippuu sen elektronipilven koosta. Jaksollisuustaulukossa alaspäin mentäessä elektronikuoria tulee lisää. Tämän seurauksena atomit kasvavat. Siirryttäessä jaksollisessa järjestelmässä oikealle, ytimeen lisätään enemmän protoneja. Elektronikuoria ei kuitenkaan lisätä. Tämä positiivisempi ydin vetää elektroneja voimakkaammin puoleensa, joten atomit pienenevät. Suurin atomi on cesium, joka on erään mallin mukaan noin 0,596 nanometriä leveä. Pienin atomi on helium, joka on noin 0,062 nanometriä leveä.
Atomien massa on 1,7×10−24 - 4,9×10 −22grammaa. Yleensä massa mitataan atomimassayksiköllä (amu), jota kutsutaan myös daltoniksi. Yksi amu on tasan 1/12 hiili-12-atomin massasta, joka on 1,7×10−24 grammaa. Vety-1:n massa on noin 1 amu, ja raskaimman tunnetun atomin, oganessonin, massa on noin 294 amu.
Miten atomit ovat vuorovaikutuksessa
Kun atomit ovat kaukana toisistaan, ne vetävät toisiaan puoleensa. Tämä vetovoima on voimakkaampi joillakin atomeilla kuin toisilla. Samalla atomien lämpö eli liike-energia saa ne jatkuvasti liikkumaan. Jos vetovoima on tarpeeksi voimakas suhteessa lämmön määrään, atomit muodostavat kiinteän aineen. Jos vetovoima on heikompi, ne muodostavat nesteen, ja jos vetovoima on vielä heikompi, ne muodostavat kaasun.
Kemialliset sidokset ovat voimakkaimpia atomien välisiä vetovoimatekijöitä. Kaikissa kemiallisissa sidoksissa elektronit liikkuvat. Atomit sitoutuvat toisiinsa yleensä siten, että niiden ulompi elektronikuori täyttyy tai tyhjenee. Reaktiivisimpien alkuaineiden on menetettävä tai saatava pieni määrä elektroneja, jotta ulkokuori olisi täynnä. Täyden ulkokuoren omaavat atomit, joita kutsutaan jalokaasuiksi, eivät yleensä muodosta sidoksia.
On olemassa kolmenlaisia sidoksia: ionisidoksia, kovalenttisia sidoksia ja metallisidoksia.
- Ionisidoksessa yksi atomi antaa elektroneja toiselle atomille. Kustakin atomista tulee ioni: atomi tai atomiryhmä, jolla on positiivinen tai negatiivinen varaus. Positiivista ionia (joka on menettänyt elektroneja) kutsutaan kationiksi; se on yleensä metalli. Negatiivista ionia (joka on saanut elektroneja) kutsutaan anioniksi; se on yleensä epämetalli. Ionisidoksen tuloksena syntyy yleensä yhteen pidettyjen ionien ristikko eli kide.
- Kovalenttisessa sidoksessa kaksi atomia jakaa elektroneja. Näin tapahtuu yleensä silloin, kun molemmat atomit ovat epämetalleja. Kovalenttiset sidokset muodostavat usein molekyylejä, joiden koko vaihtelee kahdesta atomista useampaan. Ne voivat myös muodostaa suuria verkkoja, kuten lasia tai grafiittia. Atomin solmimien sidosten määrä (sen valenssi) on yleensä se määrä elektroneja, joka tarvitaan atomin ulomman elektronikuoren täyttämiseen.
- Metallisidoksessa elektronit liikkuvat vapaasti useiden metalliatomien välillä. Mikä tahansa määrä atomeja voi sitoutua tällä tavoin. Metallit johtavat sähkövirtaa, koska sähkövaraus voi helposti virrata niiden läpi. Metallien atomit voivat liikkua toistensa ohi, joten metalleja on helppo taivuttaa, venyttää ja muokata.
Kaikki atomit vetävät toisiaan puoleensa Van der Waalsin voimilla, jotka ovat kemiallisia sidoksia heikompia. Nämä voimat syntyvät, kun elektronit siirtyvät atomin toiselle puolelle. Tämä liike antaa negatiivisen varauksen kyseiselle puolelle. Se antaa myös positiivisen varauksen toiselle puolelle. Kun kaksi atomia asettaa negatiivisen ja positiivisen varauksen omaavat puolensa riviin, ne vetävät toisiaan puoleensa.
Vaikka atomit ovat suurimmaksi osaksi tyhjää tilaa, ne eivät voi kulkea toistensa läpi. Kun kaksi atomia on hyvin lähellä toisiaan, niiden elektronipilvet hylkivät toisiaan sähkömagneettisen voiman avulla.
Magnetismi
Elektronilla on magneettimomentiksi kutsuttu ominaisuus, jolla on suunta ja suuruus (tai koko). Magneettinen momentti johtuu elektronin yksilöllisestä spinistä ja sen kiertoradasta ytimen ympärillä. Elektronien magneettiset momentit muodostavat yhdessä koko atomin magneettisen momentin. Tämä selittää atomien käyttäytymisen magneettikentässä.
Kullakin atomin elektronilla on jompikumpi kahdesta spinistä. Jos jokainen elektroni on parina elektronin kanssa, jolla on vastakkainen spin, spinit kumoavat toisensa, joten atomilla ei ole pysyvää magneettista momenttia. Tällaisia atomeja kutsutaan diamagneettisiksi: magneettikenttä hylkii niitä vain heikosti.
Jos osa elektroneista ei kuitenkaan ole paritettu, atomilla on pysyvä magneettinen momentti: se on paramagneettinen tai ferromagneettinen. Kun atomit ovat paramagneettisia, kunkin atomin magneettinen momentti osoittaa satunnaiseen suuntaan. Ne vetävät heikosti puoleensa magneettikenttää. Kun atomit ovat ferromagneettisia, lähekkäisten atomien magneettiset momentit vaikuttavat toisiinsa. Ne osoittavat samaan suuntaan. Magneettikentässä useimmat atomit asettuvat kentän suuntaisesti. Ferromagneettiset materiaalit, kuten rauta, koboltti ja nikkeli, vetävät magneettikenttää puoleensa voimakkaasti.
Radioaktiivinen hajoaminen
Joillakin alkuaineilla ja monilla isotoopeilla on niin sanottu epävakaa ydin. Tämä tarkoittaa, että ydin on joko liian suuri pitääkseen itsensä kasassa tai että siinä on liian monta protonia tai neutronia. Kun näin tapahtuu, ytimen on poistettava ylimääräinen hiukkasmassa. Se tekee sen säteilyn avulla. Atomia, joka tekee näin, voidaan kutsua radioaktiiviseksi. Epävakaat atomit säteilevät, kunnes ne menettävät riittävästi hiukkasia ytimestä tullakseen vakaiksi. Kaikki atomilukua 82 (82 protonia, lyijy) suuremmat atomit ovat radioaktiivisia.
Radioaktiivisia hajoamisia on kolmea päätyyppiä: alfa-, beeta- ja gammahajoaminen.
- Alfahajoaminen tarkoittaa, että atomi ampuu ulos hiukkasen, jossa on kaksi protonia ja kaksi neutronia. Tämä on pohjimmiltaan heliumydin. Tuloksena on alkuaine, jonka järjestysluku on kaksi pienempi kuin aiemmin. Jos esimerkiksi berylliumatomi (atomiluku 4) alfahajoaisi, siitä tulisi heliumia (atomiluku 2). Alfahajoaminen tapahtuu, kun atomi on liian suuri ja sen on päästävä eroon massasta.
- Beetahajoaminen on sitä, kun neutroni muuttuu protoniksi tai protoni muuttuu neutroniksi. Ensimmäisessä tapauksessa atomi ampuu ulos elektronin. Toisessa tapauksessa se on positroni (kuten elektroni, mutta sillä on positiivinen varaus). Tuloksena on alkuaine, jonka järjestysluku on joko yksi suurempi tai yksi pienempi kuin aiemmin. Beetahajoaminen tapahtuu, kun atomissa on joko liikaa protoneja tai liikaa neutroneja.
- Gammahajoaminen tarkoittaa sitä, että atomi lähettää gammasäteitä tai aaltoja. Se tapahtuu, kun ytimen energia muuttuu. Tämä tapahtuu yleensä sen jälkeen, kun ydin on käynyt läpi alfa- tai beetahajoamisen. Atomin massa tai järjestysluku ei muutu, ainoastaan ytimen sisälle varastoitunut energia muuttuu hiukkasten spinin muodossa.
Jokaisella radioaktiivisella alkuaineella tai isotoopilla on puoliintumisaika. Se on aika, jonka kuluessa puolet minkä tahansa näytteen atomeista hajoaa, kunnes niistä tulee eri isotooppi tai alkuaine.
Fissio ja fuusio
Ydinfissiota käyttävät laitteet alkavat ampua atomeihin neutroneja. Tämä saa atomin hajoamaan nopeasti. Yhden atomin halkeaminen laukaisee lisää neutroneita, jotka sitten hajottavat muita atomeja, jolloin syntyy ketjureaktio. Tämä prosessi tuottaa valtavia määriä lämpöenergiaa. Fissioiden ketjureaktiosta saatiin voimaa ensimmäisiin ydinaseisiin (fissiopommeihin). Ydinvoimalat ovat hieman erilaisia: fissiota hidastetaan säätösauvoiksi kutsuttujen esineiden avulla. Säätösauvat keräävät osan neutroneista, mikä estää ketjureaktion syntymisen.
Ydinfuusiota tapahtuu pääasiassa Auringossa ja muissa tähdissä. Se vaatii kuuman paikan, mutta tuottaa jopa enemmän energiaa kuin fissio. Tämä selittää auringon lämmön ja valon. Aurinko fuusioi nyt vetyä heliumiksi, kun taas suuremmat ja kuumemmat tähdet tuottavat raskaampia atomeja. Fuusiopommit eli lämpöydinaseet ovat tehokkaimpia ydinaseita. Tutkijat yrittävät tehdä fuusioreaktoreita ydinvoimaloita varten, mutta yhtään ei ole vielä olemassa.
Ydinfuusio ja ydinfissio tuottavat energiaa samankaltaisista syistä. Einsteinin kuuluisan kaavan E = mc2 mukaan pieni määrä massaa voi muuttua suureksi energiamääräksi. Kun protonit ja neutronit yhdistyvät ydinfuusiossa, ne menettävät jonkin verran massaa, jonka ne lähettävät ulos energiana. Ydin voi jakautua protoneiksi ja neutroneiksi vain, jos siihen lisätään sama määrä energiaa. Tätä kunkin ytimen ominaisuutta kutsutaan sen ydinsidosenergiaksi. Fuusio tai fissio lähettävät energiaa, jos kokonaissitoutumisenergia kasvaa. Rauta-56:n ja nikkeli-62:n ytimillä on suurin sidosenergia jaettuna niiden protonien ja neutronien lukumäärällä, joten ne eivät yleensä käy läpi fissiota tai fuusiota. Suuremmat atomit, kuten uraani, käyvät läpi ydinfission, koska se lisää niiden sidosenergiaa.
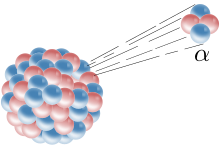
Ytimestä ammutaan ulos alfahiukkanen.
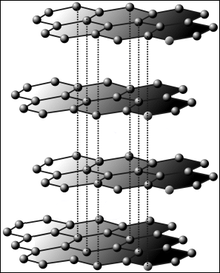
Grafiitti koostuu kerroksittain kerrostuneista hiiliatomeista. Kukin kerros pysyy koossa kovalenttisten sidosten avulla. Eri kerrosten välinen vetovoima on Van der Waalsin voima.
Muodostuminen ja esiintyminen
Lähes kaikki maailmankaikkeuden vetyatomit, suurin osa heliumatomeista ja osa litiumatomeista syntyi pian alkuräjähdyksen jälkeen. Vielä nykyäänkin noin 90 prosenttia maailmankaikkeuden kaikista atomeista on vetyä. Suuremmat atomit syntyvät tähdissä ydinfuusion avulla, kun taas suurimmat atomit syntyvät erittäin massiivisissa tähdissä tai supernovissa. Suurin osa maapallon atomeista on peräisin tähdestä, joka oli olemassa ennen Aurinkoa.
Ihmiset tekevät hyvin suuria atomeja iskemällä yhteen pienempiä atomeja hiukkaskiihdyttimissä. Nämä atomit hajoavat kuitenkin usein hyvin nopeasti. Oganessonin (alkuaine 118) puoliintumisaika on 0,89 millisekuntia. On mahdollista, että tulevaisuudessa luodaan vielä suurempia atomeja.
Aiheeseen liittyvät sivut
- Atomifysiikka, jossa kerrotaan tarkemmin atomien fysiikasta.
- Kemia, ala, joka tutkii kaikkea, mikä on tehty atomeista.
- Alkeishiukkanen, hiukkaset, jotka muodostavat atomit ja kaiken muun.
- Kvanttimekaniikka, tutkimus pienistä hiukkasista ja niiden vuorovaikutuksesta energian kanssa.
- Aineen olomuodot, atomien tai molekyylien eri muodot.
Kysymyksiä ja vastauksia
K: Mikä on atomi?
V: Atomi on aineen perusyksikkö. Se on aineen pienin yksikkö, joka voi yhdistyä muiden atomien kanssa muodostaakseen molekyylejä ja monimutkaisempaa ainetta, jolla on erityisiä kemiallisia ominaisuuksia.
K: Kuinka suuria atomit ovat?
V: Atomit ovat hyvin pieniä, läpimitaltaan 0,1-0,5 nanometriä, mikä on noin 100 000 kertaa pienempi kuin ihmisen hiuksen leveys.
K: Minkä tyyppisiä subatomisia hiukkasia atomi on?
V: Atomin muodostavat kolme subatomista hiukkastyyppiä: protonit, neutronit ja elektronit. Protonit ja neutronit ovat raskaampia ja sijaitsevat ytimessä, kun taas elektronit ovat kevyempiä ja vetävät ytimen puoleensa sähkömagneettisella voimalla vastakkaisten sähkövaraustensa vuoksi.
Kysymys: Kuinka monta alkuaineita esiintyy luonnossa maailmassa?
V: Maailmassa esiintyy luonnossa noin 92 alkuaineita.
K: Mitä tapahtuu, kun atomissa on enemmän tai vähemmän elektroneja kuin protoneja?
V: Jos atomilla on enemmän tai vähemmän elektroneja kuin protoneja, sitä kutsutaan ioniksi, ja sillä on sähkövaraus.
K: Millaisia muutoksia tapahtuu, jos atomien sisällä olevat voimat käyvät liian heikoiksi pitääkseen niitä yhdessä?
V: Jos atomien sisäiset voimat käyvät liian heikoiksi pitääkseen ne koossa, ne voivat muuttua toisenlaisiksi atomeiksi tai tuhoutua kokonaan; tätä prosessia tutkitaan ydinfysiikassa.
Etsiä