Telomeraasi: miten se pidentää telomeerejä — toiminta ja merkitys
Telomeraasi: miten entsyymi pidentää telomeerejä, sen toiminta ja merkitys ikääntymisessä ja syövässä — mekanismit, tutkimuslöydöt ja hoitopotentiaali.
Telomeraasi on RNA-proteiini, joka on entsyymi. Se lisää DNA-sekvenssin toistoja ("TTAGGG" kaikilla selkärankaisilla) DNA-säikeiden loppuun telomeerialueilla.
Telomeerit ovat kertakäyttöisiä puskureita, jotka estävät eukaryoottisten kromosomien päät. Ne ovat toistuvien nukleotidien alue, joka sisältää koodaamatonta DNA:ta. Telomeerit tuhoutuvat solun jakautumisen aikana, ja telomeraasientsyymi rakentaa ne uudelleen.
Telomeerien tehtävänä on estää tärkeän DNA:n häviäminen kromosomien päistä. Aina kun kromosomi kopioidaan, siitä häviää 100-200 merkityksetöntä nukleotidia, mikä ei aiheuta vahinkoa organismin DNA:lle. Telomeerit siis lyhenevät jokaisen replikaatiosyklin jälkeen, ja telomeraasi palauttaa ne sitten oikeaan pituuteensa. Telomeraaseilla on oma RNA-molekyylinsä, jota käytetään mallina telomeerien pidentämisessä.
Neuvostoliittolainen biologi Aleksei Olovnikov ennusti ensimmäisen kerran vuonna 1973, että telomeerien lyhenemistä kompensoiva mekanismi (korjausmekanismi) on olemassa. Hän esitti myös telomeerihypoteesin ikääntymisestä ja telomeerin yhteyksistä syöpään.
Carol Greider ja Elizabeth Blackburn löysivät telomeraasin vuonna 1984 Tetrahymena-suvun sädesienestä. Greider ja Blackburn saivat yhdessä Jack Szostakin kanssa vuoden 2009 Nobelin fysiologian tai lääketieteen palkinnon löydöstään.
Mikä on telomeraasin rakenne ja tärkeimmät komponentit?
Telomeraasi on koostumukseltaan ribonukleoproteiini, eli se sisältää sekä proteiini- että RNA-komponentin. Keskeisimmät osat ovat:
- TERT (telomerase reverse transcriptase) – katalyyttinen proteiinikomponentti, jolla on käänteiskopioijaentsyymin toiminta.
- TERC tai TR (telomerase RNA component) – RNA-malli, jonka emässekvenssi määrittää, mitä toistetta telomeraasi lisää (esim. TTAGGG selkärankaisilla).
- Lisäksi telomeraasikompleksiin kuuluu useita apuproteiineja (esim. dyskeriini, NOP10, NHP2, TCAB1), jotka stabiloivat kompleksia ja vaikuttavat sen toimintaan.
Toimintamekanismi lyhyesti
Telomeraasi liittää tumassa toimien 3'-päässä olevaan yksijuosteiseen telomeeriseen ylioteeseen RNA-mallinsa avulla uusia nukleotideja. Prosessi toimii seuraavasti:
- TERC:n antama malli hybridisoituu kromosomin 3'-pään kanssa.
- TERT katalysoi RNA-mallin kopioimisen DNA:ksi (käänteiskopiointi), ja näin telomeerinen toistojakso pidentyy.
- Telomeraasi voi siirtyä eteenpäin ja lisätä useita toistoja per sitoutumissykli, mikä parantaa prosesiivisuutta.
Missä ja milloin telomeraasi on aktiivinen?
Telomeraasin ilmeneminen on tiukasti säädeltyä:
- Se on aktiivinen kantasoluissa, itiöissä ja sukusoluissa, joissa pitkä jakautumiskyky on tarpeen.
- Aktiivoituneissa immuunisoluissa (esim. T-lymfosyytit) telomeraasi voi myös nostaa aktiivisuuttaan jakautumistarpeen yhteydessä.
- Useimmissa aikuisen elimistön somaattisissa soluissa telomeraasi on heikosti aktiivinen tai hiljainen, minkä vuoksi telomeerit lyhenevät ikääntyessä.
Telomeerien lyheneminen, ikääntyminen ja solunsurmat
Telomeerien asteittainen lyheneminen yhdistetään solujen jakautumiskyvyn menetykseen ja solujen vanhenemiseen (replicative senescence). Kun telomeri lyhenee kriittisen lyhyeksi, se tunnistetaan DNA-vauriona, mikä voi käynnistää:
- solusykliarrestin (pysähtyneen jakautumisen),
- apoptoosin (ohjatun solukuoleman) tai
- genomisen epävakauden, mikä voi edistää syöpää jos DNA-vaurion vasteet ovat heikentyneet.
Tärkeät säätelijät tässä ovat p53- ja p16INK4a-reitit sekä telomeereitä suojaava shelterin-proteiinikompleksi (esim. TRF1, TRF2, POT1, TIN2, RAP1), joka estää telomeerejä tunnistamasta kromosomin päitä vahingoiksi.
Telomeraasi ja syöpä
Telomeraasin uudelleenaktivoituminen on yleinen syövän piirre: noin 85–90 % inhimillisistä syövistä expressaa telomeraasia tai hyödyntää vaihtoehtoisia mekanismeja telomeerien pidentämiseksi (ALT, alternative lengthening of telomeres). Tämän ansiosta syöpäsolut voivat jakautua lähes rajattomasti. Tärkeitä huomioita:
- Joissakin syövissä esiintyy TERT-promootterin mutaatioita (esim. C228T, C250T), jotka lisäävät TERT:n ilmentymistä.
- Telomeraasin esto on tutkittu antikantasyöpästrategiana; esim. imetelstat on telomerasa-entsyymin inhibiittori, joka on ollut kliinisissä tutkimuksissa.
- ALT-reitti perustuu homologiseen rekombinaatioon ja esiintyy osassa syövistä, etenkin tietyissä osteosarkoomissa ja gliomaissa.
Perinnölliset sairaudet ja kliininen merkitys
Teloomerien ylläpitoon liittyvät geenit voivat myös aiheuttaa perinnöllisiä sairauksia, jos ne ovat viallisia. Esimerkkejä:
- Dyskeratosis congenita – joukko oireita, jotka johtuvat telomeraasin komponenttien mutaatioista (esim. DKC1, TERC, TERT) ja johtavat mm. luuydinvaurioon ja muiden kudosten vajaatoimintaan.
- Lyhyet telomeerit liittyvät myös idiopaattiseen keuhkofibroosiin ja muuhun kudosvaurioon.
Mittaus ja tutkimusmenetelmät
Telomeerien pituutta ja telomeraasiaktiivisuutta mitataan useilla tavoilla:
- TRF (terminal restriction fragment) -analyysi (Southern blot) antaa absoluuttisen pituusarvion.
- qPCR-pohjaiset menetelmät mittaavat suhteellista telomeerin pituutta monista näytteistä nopeasti.
- Flow-FISH yhdistää fluoresenssitittimisen in situ -hybridisaation (FISH) solujen lajitteluun (flow cytometry) ja mittaa telomeerinpituutta solutason mittauksena.
- Telomeraasiaktiivisuutta voidaan arvioida TRAP-assaylla (telomeric repeat amplification protocol).
Mahdollisuudet lääketieteessä ja turvallisuushaasteet
Telomeraasin manipulointi tarjoaa lupaavia mutta haastavia mahdollisuuksia:
- Telomeraasin aktivointi saattaa tukea kudosten korjausta ja kantasolutoimintaa ikääntymisen tai kudosvaurion yhteydessä, mutta siihen liittyy riski syövän lisääntymisestä.
- Telomeraasin esto on antikantasyöpästrategia, mutta se voi vaatia pitkän ajan ennen vaikutusta, koska telomeerit lyhenevät asteittain.
- Farmakologiset ja geeniterapeuttiset lähestymistavat ovat aktiivisessa tutkimuksessa; tasapainon löytäminen turvallisuuden ja tehon välillä on keskeistä.
Lisätietoja ja tutkimuksen suuntaukset
Tutkimus jatkuu monilla rintamilla: telomerien roolin tarkentaminen eri elimissä, telomeraasin sääntely molekyylitasolla, TERT:n ei-telomeeriset funktiot (esim. vaikutukset mitokondrioihin ja oksidatiivisen stressin säätelyyn) sekä uusien terapeuttisten modulaattoreiden kehitys. Telomeerien ja telomeraasin tutkimus yhdistää biologiaa, genetiikkaa ja kliinistä lääketiedettä — ja sillä on merkittäviä seurauksia ikääntymisen, kudosteknologian ja syövän hoidossa.
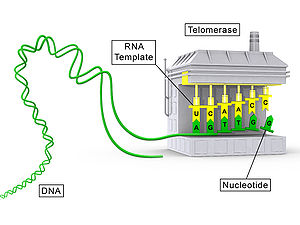
Käsitteellinen kaavio, jossa telomeraasin proteiinikomponentti (TERT) on harmaalla ja RNA-komponentti (TR) keltaisella.
Kysymyksiä ja vastauksia
K: Mikä on telomeraasi?
V: Telomeraasi on RNA-proteiinientsyymi, joka lisää DNA-sekvenssitoistoja DNA-juosteiden loppuun telomeerialueilla.
K: Mitä telomeerit ovat?
V: Telomeerit ovat kertakäyttöisiä puskureita, jotka estävät eukaryoottisten kromosomien päät. Ne koostuvat toistuvista nukleotideista, jotka sisältävät koodaamatonta DNA:ta.
K: Mikä on telomeerien tehtävä?
V: Telomeerien tehtävänä on välttää tärkeän DNA:n häviäminen kromosomien päistä kompensoimalla 100-200 merkityksetöntä nukleotidia, jotka häviävät jokaisen replikaatiosyklin aikana.
K: Kuka ennusti ensimmäisenä telomeerien lyhenemistä kompensoivan mekanismin?
V: Neuvostoliittolainen biologi Aleksei Olovnikov ennusti ensimmäisenä telomeerien lyhenemistä kompensoivan mekanismin vuonna 1973.
K: Kuka löysi telomeraasin?
V: Carol Greider ja Elizabeth Blackburn löysivät telomeraasin vuonna 1984 Tetrahymena-suvun sädesienestä.
K: Mistä Greider, Blackburn ja Szostak palkittiin?
V: Greider, Blackburn ja Szostak saivat vuonna 2009 Nobelin fysiologian tai lääketieteen palkinnon telomeraasin löytämisestä.
K: Miten telomeraasi toimii? V: Telomeraaseilla on oma RNA-molekyylinsä, joka toimii mallina lyhentyneiden telomeerien pidentämiseksi jokaisen replikaatiosyklin jälkeen.
Etsiä