Elektrofiili: kemian määritelmä, esimerkit ja reaktiot
Elektrofiili: selkeä kemian määritelmä, käytännön esimerkit ja reaktiomekanismit — opi miten elektrofiilit toimivat additioissa, hapetusreaktioissa ja nukleofiilien kanssa.
Kemiassa elektrofiili on molekyyli tai atomi, joka ottaa mielellään elektroneja toiselta. Monilla elektrofiileillä on positiivinen varaus. Niitä kutsutaan myös Lewis-hapoiksi. Esimerkkejä elektrofiileistä ovat molekyylit, joissa atomeilla on suuri elektronegatiivisuusero, kuten HCl tai karbonyyli, tai myös hapettavat aineet.
Elektrofiilien kimppuun hyökkää nukleofiili, joka on vastakkainen molekyylityyppi. Näin tapahtuu esimerkiksi additioreaktioissa.
Mitä elektrofiili tarkoittaa käytännössä?
Yksinkertaisesti sanottuna elektrofiili on elektronien hyväksyjä. Se voi olla:
- positiivisesti varautunut hiili- tai muu atomi (esim. karbokationit),
- elektronitiheydeltään alttiiksi muuttunut atomikeskus esimerkiksi polaarisessa sidoksessa (Cδ+ karbonyyliryhmässä),
- Lewis-happotyyppinen molekyyli tai ioni, joka voi vastaanottaa elektroniparin (esim. AlCl3, BF3) tai protoni (H+),
- elektrofiiliset kokoa suuret lajit kuten halogeni- tai nitrosyyliryhmät (esim. Br2, NO2+).
Tyypillisiä esimerkkejä
Arkipäiväisiä ja laajasti esiintyviä elektrofiilejä ovat muun muassa:
- HCl ja muut protolysoituvat hapot (protoni toimii elektrofiilina),
- karbonyylisysteemien karbonyylihiili (Cδ+), jolle nukleofiili voi liittyä,
- halogeenimolekyylit (Br2, Cl2) ja halonium-ionit,
- ympäröivistä ryhmistä riippuen muodostuvat karbokationit (esim. additioreaktioissa).
Reaktiomekanismit, joissa elektrofiilit osallistuvat
Elektrofiilit ovat keskeisiä monissa orgaanisissa reaktioissa:
- Elektrofiilinen additio (esim. alkeenien reaktiot halogeenin tai happojen kanssa): elektrofiili lisääntyy kaksinkertaisen sidoksen lähelle ja usein muodostuu karbokationiväli- tai halonium-ioneja, joita nukleofiilit hyökkäävät.
- Elektrofiilinen substituutio (esim. aromaattinen sub.: nitröinti, halogenaatio, sulfonointi): sähkövetoinen elektrofiili muodostaa väliaikaisen sigma-kompleksin, joka palautuu deprotonoinnin kautta korvaten vedyn.
- Akylointi ja asylointi Friedel–Crafts-tyyppisissä reaktioissa, joissa Lewis-happojen avulla muodostetaan vahvoja elektrofiilejä (esim. R+ tai acylium-ionit).
- Hapetus- ja redox-reaktiot, joissa elektrofiili voi olla myös elektroneja vastaanottava hapettava aine (esim. halogeenit, NO2+); huomaa kuitenkin, että kaikki elektrofiilit eivät ole samalla kertaa hapettimia.
Mitä vaikuttaa elektrofiilisyyteen?
Tärkeitä tekijöitä, jotka määräävät kuinka voimakas elektrofiili on:
- Positiivinen varaus tai osittaisvaraus (Cδ+): mitä suurempi positiivisuus, sitä vahvempi elektrofiili.
- Induktiivinen ja resonance-vaikutus: elektronegatiiviset substituentit lisäävät elektrofiilisyyttä indusoimalla positiivista osittaisvarausta; toisaalta resonanssilla pelastavat ryhmät voivat vähentää sitä.
- Polarisoituvuus: suuret, helposti polarisoituvat atomit voivat muodostaa voimakkaita elektrofiilejä (esim. I2 verrattuna F2).
- Happous/Lewis-aktiivisuus: vahvat hapot tai Lewis-hapot (H+, AlCl3) generoivat tai stabiloivat elektrofiilejä.
- Solventti ja lämpötila: polaariset liuottimet voivat stabiloida ioneja ja muuttaa reaktionopeuksia; lämpötila vaikuttaa energiapotentiaaleihin.
- Sterinen este: suurikokoinen ympäristö voi hidastaa nukleofiilin pääsyä elektrofiiliseen keskukseen.
Kuinka tunnistaa elektrofiilinen keskus
Usein elektrofiilisen atomin voi päätellä seuraavista merkeistä:
- positiivinen varaus tai osittaisvaraus (Cδ+, Nδ+),
- atomilla on vajaus elektronien suhteen (esim. karbokationi),
- atomia ympäröivät elektronegatiiviset substituentit tai konjugaatio, joka vetää elektronitiheyttä pois.
Yhteenveto
Elektrofiilit ovat elektronien vastaanottajia, keskeisiä monissa orgaanisissa ja epäorgaanisissa reaktioissa. Ne toimivat usein yhdessä nukleofiilien kanssa muodostaen uusia sidoksia. Elektrofiilisyyteen vaikuttavat varaus, substituentit, polarisoituvuus, liuotin ja steriikka. Tuntemalla tavallisimmat elektrofiilit (esim. protoneja, karbokationeja, karbonyylihiiliä, halogeeneja ja Lewis-happoja) ja niiden käyttäytymisen voi ennustaa ja suunnitella kemiallisia reaktioita tarkemmin.
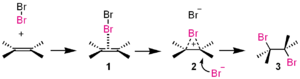
Tässä additioreaktiossa bromi (Br2 ) on elektrofiili.
Kysymyksiä ja vastauksia
K: Mikä on elektrofiili?
V: Elektrofiili on molekyyli tai atomi, joka ottaa mielellään elektroneja toiselta.
K: Miksi elektrofiilejä kutsutaan myös Lewis-hapoiksi?
V: Elektrofiilejä kutsutaan myös Lewis-hapoiksi, koska ne voivat ottaa vastaan elektronipareja toisilta molekyyleiltä.
K: Mitkä ovat esimerkkejä elektrofiileistä?
V: Joitakin esimerkkejä elektrofiileistä ovat molekyylit, joissa atomeilla on suuri elektronegatiivisuusero, kuten HCl tai karbonyyli, tai myös hapettavat aineet.
K: Miten nukleofiilit reagoivat elektrofiilien kanssa?
V: Nukleofiilit reagoivat elektrofiilien kanssa hyökkäämällä niihin.
K: Mikä on nukleofiili?
V: Nukleofiili on elektrofiilin vastakohtainen molekyyli. Se on molekyyli tai atomi, joka luovuttaa mielellään elektroneja.
K: Miten additioreaktiot tapahtuvat elektrofiilien ja nukleofiilien välillä?
V: Additioreaktioita tapahtuu elektrofiilien ja nukleofiilien välillä, kun nukleofiili hyökkää elektrofiilin kimppuun muodostaen uuden sidoksen.
K: Voiko elektrofiilillä olla negatiivinen varaus?
V: Elektrofiilillä voi olla positiivinen varaus, mutta sillä voi olla myös osittainen positiivinen varaus tai ei lainkaan varausta. Tärkein ominaisuus on, että se on halukas ottamaan vastaan elektroneja.
Etsiä