pH-arvo (happamuus) – määritelmä, kaava ja pH-asteikko 0–14
pH-arvo (happamuus): selkeä opas, määritelmä, laskukaava ja pH-asteikko 0–14. Yksinkertaiset esimerkit ja selitykset happamille, neutraaleille ja emäksisille liuoksille.
pH on happamuuden asteikko 0-14. Se kertoo, kuinka hapan tai emäksinen aine on. Happamilla liuoksilla on matalampi pH. Emäksisemmillä liuoksilla on korkeampi pH. Aineilla, jotka eivät ole happamia tai emäksisiä (eli neutraaleilla liuoksilla), on yleensä pH 7. Happojen pH on pienempi kuin 7. Emäksillä on pH, joka on suurempi kuin 7.
pH mittaa protonien (H+) pitoisuutta liuoksessa. S.P.L. Sørensen esitteli tämän käsitteen vuonna 1909. P tarkoittaa saksankielistä potenzia, joka tarkoittaa voimaa tai konsentraatiota, ja H vetyionia (H+).
Yleisin kaava pH:n laskemiseksi on:
pH = - log 10 [ H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}
[H+] ilmaisee H+-ionien pitoisuuden (kirjoitetaan myös [H3O+], joka vastaa hydroniumionien pitoisuutta), mitattuna mooleina litrassa (tunnetaan myös nimellä molaarisuus).
Oikea yhtälö on kuitenkin itse asiassa:
pH = - log 10 [ a H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}
jossa a H + {\displaystyle a_{\mathrm {H^{+}} }} 
Useimpien aineiden pH on välillä 0-14, mutta erittäin happamien tai emäksisten aineiden pH voi olla < 0 tai > 14.
Emäksisissä aineissa on vetyionien sijasta hydroksidi-ionien (OH-) pitoisuus.
Mitä pH tarkoittaa käytännössä?
pH kertoo, kuinka runsas vetyionien (H+) määrä liuoksessa on. pH on logaritminen asteikko: yhden pH-yksikön muutos vastaa kymmenkertaista muutosta H+-pitoisuudessa. Esimerkiksi pH 3 on kymmenen kertaa happamampi kuin pH 4 ja 100 kertaa happamampi kuin pH 5.
Esimerkkejä pH-arvoista
- Vetyperoksidi- tai akkuhappo: hyvin matala pH (noin 0–1).
- Ruuansulatusneste (mahahappo): noin pH 1–3.
- Sitruuna- tai viinietikka: noin pH 2–3.
- Puhdas vesi (25 °C): pH ~7 (neutraali).
- Ihanteellinen veren pH: noin 7,35–7,45 (hiukan emäksinen).
- Saippua- tai pesuliuokset: yleensä pH > 7.
- Ammoniakkiliuos: usein pH 11–12 (emäksinen).
Miten pH lasketaan käytännössä?
Yksinkertainen laskuesimerkki:
- Jos [H+] = 1,0 × 10–3 mol/l, niin pH = –log10(1,0 × 10–3) = 3.
- Jos [H+] = 1,0 × 10–7 mol/l, niin pH = 7 (neutraali veden tapauksessa 25 °C).
Jos käytetään aktiviteettia aH+ laskussa, sama periaate pätee, mutta aH+ korjaa efektiivisen konsentraation huomioiden ionien vuorovaikutukset erityisesti väkevämmissä liuoksissa.
Veden autoionisaatio ja pOH
Vesi ionisoituu hieman: H2O ⇌ H+ + OH–. Tasapainovakio Kw = [H+][OH–]. 25 °C:ssa Kw on noin 1,0 × 10–14, mistä seuraa pH + pOH = 14 (kun logaritmi käytetään kantaluvulla 10). Tämä suhde riippuu lämpötilasta: korkeammassa lämpötilassa Kw kasvaa, jolloin neutraali pH (missä [H+] = [OH–]) ei ole tarkalleen 7.
Mittaustavat
- pH-mittari (lasielektrodi) – tarkin tapa laboratorioissa ja kentällä, mittaa elektrodiin kohdistuvaa potensiaalieroa.
- Indikaattorit – väri-indikaattorit tai universaali pH-paperi antavat suuntaa antavan arvion. Indikaattorit muuttavat väriään tietyn pH-alueen yli.
- Potentiaalisuuteen perustuvat menetelmät – esimerkiksi ioniselektiiviset elektrodit muille ioneille, joista voidaan päätellä pH:tä epäsuorasti.
Käyttötarkoituksia ja merkitys
- Kemian ja teollisuuden prosessien hallinta (esim. pesuaineet, kemialliset reaktiot).
- Ympäristöseuranta (pintavesien happamuus, happamoituminen).
- Eläin- ja kasvikunnan terveys (maaperän pH, verenkemia).
- Ruoka- ja juomatuotanto (säilyvyys, maku ja mikrobiologia).
Turvallisuus
Erittäin matala (< 2) tai korkea (> 12) pH voi olla erittäin syövyttävä ja aiheuttaa vammoja kosketuksessa. Käytä sopivia suojavälineitä käsitellessäsi vahvasti happamia tai emäksisiä aineita.
Lyhyt yhteenveto
- pH on logaritminen mitta H+-ionien määrälle liuoksessa: pH = –log10[H+] (tai tarkemmin –log10 aH+).
- Arvo 7 on likimääräinen neutraali 25 °C:ssa, arvo < 7 on hapan ja > 7 emäksinen.
- pH vaikuttaa kemiallisiin reaktioihin, biologisiin toimintoihin ja teollisiin prosesseihin.
pH-indikaattorit
Tietyt väriaineet vaihtavat väriä sen mukaan, ovatko ne happamassa vai emäksisessä liuoksessa . pH-indikaattori on kemiallinen yhdiste, jota lisätään pieniä määriä liuokseen, jotta liuoksen pH (happamuus tai emäksisyys) voidaan havaita. pH-indikaattori on hydroniumionien (H3O+) tai vetyionien (H+) kemiallinen ilmaisin. Normaalisti indikaattori saa aikaan sen, että liuoksen väri muuttuu pH:n mukaan.
Tyypillisiä indikaattoreita ovat fenolftaleiini, metyylioranssi, metyylipuna, bromitymolisininen ja tymolisininen. Ne kaikki muuttavat väriä pH-asteikon eri kohdissa, ja niitä voidaan käyttää yhdessä yleisindikaattorina.
Toinen tapa on käyttää lakmuspaperia, joka perustuu luonnollisiin pH-indikaattoreihin. Paperi voi kertoa, kuinka vahva kemikaali on, onko se vahvempi happo vai vahvempi emäs.
Joitakin yleisiä pH-arvoja
| pH | |
| Akkuhappo | 0 |
| Mahahappo | 1.0 |
| Sitruunamehu | 2.4 |
| Cola | 2.5 |
| Hapetettu vesi | 2.5 - 3.0 |
| Etikka | 3.0 |
| Appelsiini- tai omenamehu | 3.0 |
| Olut | 4.5 |
| Kahvi | 5.0 |
| Maito | 6.6 |
| 7.0 | |
| Veri | 7.35 - 7.45 |
| Tavallinen shampoo | 8.0 |
| Merivesi | 8.0 |
| Pysyvä aalto | 8.5 - 9.2 |
| 9.0 - 10.0 | |
| Hiusten värjäys | 9.5 - 10.5 |
| Taika suora | 11.5 |
| Kotitalouksien ammoniakki | 11.5 |
| Bleach | 12.3 |
| Kaustinen sooda | 12.7 |
| Kotitalouksien lipeä | 13.5 |
| Viemärin puhdistusaine | 14 |
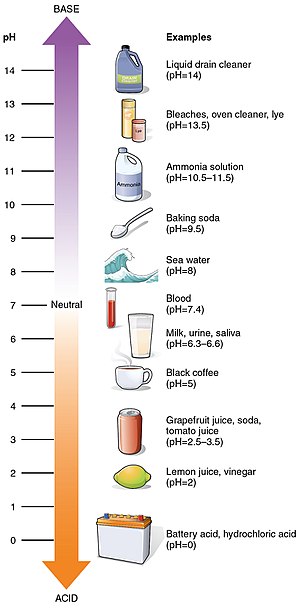
Joidenkin yleisten aineiden pH-arvot
Neutralointi
Neutralointi voidaan tiivistää yhtälön avulla:
H+
+ OH-
→ H
2O
Aiheeseen liittyvät sivut
Kysymyksiä ja vastauksia
Q: Mikä on pH?
V: pH on happamuusasteikko 0-14, joka mittaa protonien (H+) pitoisuutta liuoksessa. Se kertoo, kuinka hapan tai emäksinen aine on, jolloin happamilla liuoksilla on matalampi pH ja emäksisillä liuoksilla korkeampi pH. Neutraalien liuosten pH on yleensä 7.
K: Kuka otti käyttöön pH:n käsitteen?
V: S.P.L. Sørensen esitteli tämän käsitteen vuonna 1909.
K: Mitä tarkoittaa "p" sanassa "pH"?
V: "p" tarkoittaa saksankielistä sanaa potenz, joka tarkoittaa voimaa tai konsentraatiota.
K: Miten pH lasketaan?
V: Yleisin kaava pH:n laskemiseksi on ottaa negatiivinen logaritmi, joka on 10 kertaa H+-ionien (kirjoitetaan myös [H3O+], mikä tarkoittaa yhtä suuria hydroniumionien pitoisuuksia) pitoisuuden negatiivinen logaritmi mitattuna mooleina litraa kohti (tai molaarisuus). On kuitenkin olemassa myös yhtälö, jossa otetaan huomioon aktiivisuus pelkän konsentraation sijasta, mikä voi tilanteesta riippuen antaa erilaisia arvoja kuin yleisempi kaava.
Kysymys: Millä alueella useimmat aineet ovat pH-asteikolla?
V: Useimpien aineiden pH-arvo on välillä 0-14, vaikka erittäin happamien tai emäksisten aineiden pH-arvo voi olla tämän alueen ulkopuolella (pienempi kuin 0 tai suurempi kuin 14).
K: Miten emäksiset aineet eroavat happamista aineista pH-asteikolla? V: Emäksisillä aineilla on asteikolla korkeampia arvoja, koska ne sisältävät hydroksidi-ioneja (OH-) vetyionien sijaan, kuten hapot.
Etsiä
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)