Happo (kemia): määritelmä, pH, protonit, vahvat ja heikot hapot
Happo (kemia) — selkeä määritelmä: pH, protonien luovutus, vahvat ja heikot hapot sekä niiden vaikutus liuosten pH-arvoihin ja käytännön esimerkit.
Tietokantojen tiettyjä ominaisuuksia käsittelevä artikkeli on osoitteessa ACID.
Joskus happo on toinen nimi huumeelle LSD (lysergihappodietyyliamidi).
Määritelmä
Happo on aine, joka voi luovuttaa vetyionin (H+) — käytännössä protonin — toiselle aineelle. Tämä kuvaa Brønsted–Lowryn happo-emäs -määritelmää. Toisaalta happo voidaan määritellä myös Lewis-happona, eli elektroniparien hyväksijänä. Tavallisessa vesiliuoksessa hapon liuos sisältää runsaasti vapaita H+-ioneja, ja sen pH on yleensä alle 7,0. pH kertoo vetyionien konsentraation liuoksessa: pH = −log[H+].
Protonit, dissosiaatio ja konsentraatio
Happi voi luovuttaa protonin, kun vety on sitoutunut elektronegatiiviseen atomiin, kuten happeen, typpeen tai klooriin. Kun happo H–A dissosioituu vedessä: H–A ⇌ H+ + A−, osa molekyyleistä voi jäädä dissosioitumatta. Tätä tasapainoa kuvaa happovakio Ka; sen negatiivinen logaritmi on pKa. Mitä suurempi Ka (tai mitä pienempi pKa), sitä vahvempi happo ja sitä suurempi osuus molekyyleistä dissosioituu.
Vahvat ja heikot hapot
- Vahvat hapot dissosioituvat lähes täydellisesti vedessä; lähes kaikki molekyylit luovuttavat protonin. Esimerkkejä vahvoista hapoista ovat suolahappo (HCl), typpihappo (HNO3) ja rikkihappo (H2SO4, erityisesti ensimmäinen protoni). Vahvojen happojen Ka on hyvin suuri ja pKa pieni (usein negatiivinen tai lähellä nollaa).
- Heikot hapot dissosioituvat vain osittain; merkittävä osa molekyyleistä pysyy protonin kanssa sitoutuneena. Tyypillisiä heikkoja happoja ovat etikkahappo (CH3COOH), fluorivetyhappo (HF) ja hiilihappo (H2CO3). Heikkojen happojen pKa on yleensä suurempi ja Ka pieni. Heikon hapon vesiliuoksen pH voi vaihdella laajasti riippuen konsentraatiosta (usein pH-arvot laboratoriossa osuvat esimerkiksi välille ~2–6, mutta tämä ei ole tiukka raja).
On tärkeää erottaa happojen vahvuus (kyky luovuttaa protoni, eli dissosiaatioaste) ja konsentraatio (kuinka paljon happoa liuoksessa on). Laimealla vahvalla hapolla voi olla sama pH kuin väkevällä heikolla hapolla.
Moniprotiset hapot
Jotkin hapot voivat luovuttaa useamman protonin per molekyyli; tällaisia kutsutaan polyprotisiksi (esim. H2SO4, H3PO4). Jokainen protonin luovutus vastaa omaa dissosiaatiovakioaan (Ka1, Ka2, …) ja voi olla eriasteisesti vahva tai heikko.
Konjugaatit, neutralointi ja puskurit
Kun happo luovuttaa protonin, syntyy konjugoitunut emäs (A−). Emäs on hapon "kemiallinen vastakohta": se ottaa vastaan protonin. Esimerkiksi emäs voi hyväksyä vetyionin ja usein vapauttaa hydroksidi-ioneja (OH−) vedessä. Happojen ja emästen reaktio, neutraloituminen, tuottaa yleensä suolan ja vettä: H+ + OH− → H2O. Heikko happo yhdessä sen konjugoidun emäksen kanssa muodostaa puskuriliuoksen, joka vastustaa pH:n muutoksia.
pH käytännössä
pH riippuu sekä hapon vahvuudesta että konsentraatiosta. pH voidaan arvioida suoraan pH-mittarilla tai laskea käyttämällä Ka-arvoja ja lähtökonsentraatiota. Esimerkiksi monoprotisen heikon hapon ([HA]0) pH voidaan laskea approksimaatiosta x^2/( [HA]0 − x) = Ka, jossa x ≈ [H+].
Esimerkkejä ja sovelluksia
- Laboratoriossa ja teollisuudessa happoja käytetään mm. puhdistuksessa, liuottimina, prosessikemikaaleina ja lannoitteiden valmistuksessa.
- Biologiassa monet entsyymit ja biologiset prosessit ovat herkkiä pH:lle — siksi elimistössä on tehokkaita puskureita.
- Arjen esimerkkejä: sitruunamehu (sitruunahappo) on hapan, ruokasooda (natriumhydroksidi) on emäksinen.
Turvallisuus
Hapot voivat olla syövyttäviä ja vaarallisia iholle, silmille ja hengitysteille. Työskentely happojen kanssa edellyttää asianmukaisia suojavarusteita (käsineet, suojalasit, hyvä ilmanvaihto) ja tietoa neutraloitumisesta ja hävittämisestä. Polymeerien tai metallien kanssa voimakkaat hapot voivat reagoida voimakkaasti — aina tarkista aineiden ominaisuudet ennen käyttöä.
Yhteenveto
Happo on protonin luovuttaja (Brønsted–Lowry) tai elektroniparien hyväksyjä (Lewis). Happojen pH on yleensä alle 7 vesiliuoksissa, mutta tarkka pH riippuu sekä hapon vahvuudesta (Ka/pKa) että konsentraatiosta. Vahvat hapot dissosioituvat lähes täydellisesti, heikot vain osittain. Konseptit kuten konjugoituneet emäkset, puskurit ja moniprotisuus ovat keskeisiä happojen käytössä ja ymmärtämisessä.

Suolahappo (dekantterilasissa) reagoi ammoniakkihuurujen kanssa tuottaen ammoniumkloridia (valkoinen savu).
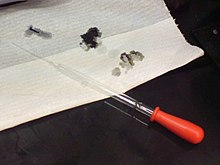
Hapot voivat olla vaarallisia: Reiät paperiin tehtiin 98-prosenttista rikkihappoa sisältävällä liuoksella.
Miten hapot toimivat
Hapot ja emäkset ovat yleensä tasapainossa keskenään. Tämä tarkoittaa sitä, että hapon näytteessä jotkut molekyylit luovuttavat protoninsa ja toiset ottavat ne vastaan. Jopa vesi on happaman ionin, H3 O +(jota kutsutaan hydroniumioniksi) ja emäksisen ionin, OH- (jota kutsutaan hydroksidi-ioniksi), seos. Hydroniumioni luovuttaa protoninsa hydroksidi-ionille muodostaen kaksi molekyyliä H2 O:ta, joka on neutraali. Tätä reaktiota tapahtuu jatkuvasti vesinäytteessä, mutta kaiken kaikkiaan näyte on neutraali, koska näytteessä on yhtä paljon hydroniumia ja hydroksidia. Useimmissa reaktioissa happoja ja emäksiä ei kuitenkaan ole yhtä paljon, ja tämä epätasapaino mahdollistaa kemiallisen reaktion tapahtumisen.
Jokaisella hapolla on konjugaattiemäs, joka muodostuu poistamalla hapon protoni. Esimerkiksi suolahappo (HCl) on happo ja sen konjugaattiemäs on kloori-anioni eli Cl- . Happo ja sen konjugaattiemäs ovat voimakkuudeltaan vastakkaisia. Koska HCl on vahva happo, Cl-on heikko emäs.
Ominaisuudet
Hapot voivat olla eri vahvuisia, toiset ovat reaktiivisempia kuin toiset. Reaktiivisemmat hapot ovat usein vaarallisempia.
Hapoilla voi olla paljon erilaisia ominaisuuksia riippuen niiden molekyylirakenteesta. Useimmilla hapoilla on seuraavat ominaisuudet:
- maistuvat happamilta syötyinä
- voivat kirvellä ihoa, kun niitä kosketetaan.
- voi syövyttää (tai syödä) metalleja ja ihoa.
- voidaan käyttää reagoivana aineena elektrolyysin aikana, koska siinä on liikkuvia ioneja.
- muuttaa sinisen lakmuspaperin punaiseksi
- muuttuu punaiseksi tai oranssiksi yleisilmaisimessa
- johtaa sähköä
Hapot voivat polttaa ihoa, ja palovamman vakavuus riippuu hapon tyypistä ja pitoisuudesta. Nämä kemialliset palovammat vaativat välitöntä lääkärinhoitoa.
Koska hapot luovuttavat vetyioneja, kaikissa hapoissa on oltava vetyä.

Varoituskuva käytetään vaarallisten happojen ja vaarallisten emästen kanssa. Emäkset ovat happojen vastakohtia.
Tärkeys
Hapot ovat tärkeitä. Nukleiinihapot, kuten DNA ja RNA, sisältävät geneettisen koodin. Nämä molekyylit määrittävät monia organismin ominaisuuksia, ja ne siirtyvät vanhemmilta jälkeläisille. DNA sisältää suunnitelmat siitä, miten aminohapoista koostuvia proteiineja rakennetaan.
Rasvahapot ja rasvahappojohdannaiset ovat toinen karboksyylihappojen ryhmä, jolla on merkittävä rooli biologiassa. Ne sisältävät pitkiä hiilivetyketjuja, joiden toisessa päässä on karboksyylihapporyhmä. Lähes kaikkien eliöiden solukalvo koostuu pääasiassa fosfolipidikaksoiskerroksesta, joka on hydrofobisten rasvahappoketjujen ja polaaristen, hydrofiilisten fosfaatti-"pää"-ryhmien muodostama mikkeli.
Ihmisillä ja monilla muilla eläimillä suolahappo on osa mahalaukussa erittyvää mahahappoa. Se voi auttaa hydrolysoimaan proteiineja ja polysakkarideja. Se voi myös muuntaa inaktiivisen proentsyymin, pepsinogeenin, entsyymiksi, pepsiiniksi. Jotkut eliöt tuottavat happoja puolustautumista varten; esimerkiksi muurahaiset tuottavat muurahaishappoa ja mustekalat mustaa happoa nimeltä magneta.
Useimpia happoja löytyy luonnosta. Joitakin näistä ovat muun muassa seuraavat:
- Etikka on luultavasti yksi tunnetuimmista; se sisältää etikkahappoa, joka antaa sille sen tunnetun maun.
- Typpihappo, NHO3, tunnetaan noin 1200-luvulta lähtien.
- Sitruunahappoja, C 6H8 O7, on monissa hedelmissä. Geber löysi ne todennäköisesti 800-luvulla.
- Carl Wilhelm Scheele löysi maitohapon, C 3H6 O3, vuonna 1780. Sitä on hapanmaitotuotteissa, kuten jogurtissa.
- Rikkihapon, H2 SO4, löysi todennäköisesti Geber. Nykyään sitä esiintyy paristoissa.
Aiheeseen liittyvät sivut
- Alkali
- Foolihappo
Kysymyksiä ja vastauksia
K: Mikä on HAPPO?
V: ACID on artikkeli tietokantojen tietyistä ominaisuuksista.
K: Mitä happo yleensä on?
V: Happo yleensä on aine, joka voi luovuttaa vetyionin (H+) toiselle aineelle ja jonka pH on alle 7,0.
K: Millä edellytyksillä kemikaali voi luovuttaa protonin?
V: Kemiallinen aine voi luovuttaa protonin, jos vetyatomi on kiinnittynyt elektronegatiiviseen atomiin, kuten happeen, typpeen tai klooriin.
K: Mitä eroa on vahvoilla hapoilla ja heikoilla hapoilla?
V: Vahvat hapot päästävät irti kaikki protoninsa, kun taas heikot hapot pitävät osan niistä. Molekyyliä kohti vapautuvien ionien määrä määrittää, onko happo heikko vai vahva.
K: Mikä on heikkojen happojen ja vahvojen happojen pH-alue?
V: Heikkojen happojen pH-arvo on yleensä 4-6, kun taas vahvojen happojen pH-arvo on 1-3.
K: Mikä on emäs?
V: Emäs on hapon "kemiallinen vastakohta". Emäs on aine, joka hyväksyy hapon vetyatomin. Emäkset ovat molekyylejä, jotka voivat hajota vedessä ja vapauttaa hydroksidi-ioneja.
K: Mitä LSD on?
V: LSD (lysergihappodietyyliamidi) on huume, jota joskus kutsutaan hapoksi, mutta se ei liity tässä artikkelissa mainittuun happoon.
Etsiä