Proteiinien taittuminen – määritelmä, vaiheet ja merkitys
Proteiinien taittuminen – selkeä määritelmä, vaiheet ja merkitys: miten kolmiulotteinen rakenne syntyy, miksi oikea taittuminen on elintärkeää ja yhteys sairauksiin.
Proteiinien taittuminen on prosessi, jonka avulla proteiini saa toiminnallisen muotonsa tai "konformaationsa". Se on pääasiassa itseorganisoituva prosessi. Polypeptidit taittuvat satunnaisesta kierteestä lähtien niille ominaiseen toimintamuotoon. Rakenne pysyy koossa vetysidosten avulla.
Vaiheet ovat:
- Kukin proteiini on olemassa taitamattomana polypeptidinä tai satunnaisena kierteenä, kun se käännetään mRNA-sekvenssistä lineaariseksi aminohappoketjuksi. Tällä polypeptidillä ei ole kehittynyttä kolmiulotteista rakennetta (yläkuvan vasen puoli).
- Aminohapot ovat vuorovaikutuksessa toistensa kanssa, jolloin syntyy hyvin määritelty kolmiulotteinen rakenne, taitettu proteiini (kuvan oikealla puolella). Tätä kutsutaan natiiviksi tilaksi. Tuloksena syntyvä kolmiulotteinen rakenne määräytyy aminohapposekvenssin perusteella (Anfinsenin dogma).
Proteiini ei toimi ilman oikeaa kolmiulotteista rakennettaan. Jotkin proteiinien osat eivät kuitenkaan taitu: tämä on normaalia.
Jos proteiinit eivät taitu natiiviin muotoonsa, ne ovat inaktiivisia ja yleensä myrkyllisiä. Useiden sairauksien uskotaan johtuvan väärin taitetuista proteiineista. Monet allergiat johtuvat proteiinien taittumisesta, sillä immuunijärjestelmä ei tuota vasta-aineita kaikille mahdollisille proteiinirakenteille.
Miten taittuminen tapahtuu — voimat ja rakenteen tasot
Proteiinin kolmiulotteinen rakenne muodostuu usealla hierarkkisella tasolla:
- Primäärirakenne = aminohapposekvenssi.
- Sekundäärirakenne = paikalliset rakenteet, kuten α-kierrepätkät ja β-levyt, joita stabiloivat vetysidokset.
- Tertiaarirakenne = koko polypeptidin kolmiulotteinen muoto, joka syntyy sivuketjujen välisistä vuorovaikutuksista.
- Kvaternäärirakenne = useamman polypeptidiketjun muodostama kompleksi (jos proteiini toimii multimeerisenä).
Taittumisen ajureina toimivat useat fysikaalis-kemialliset voimat: hydrofobinen efekti (veden välttämisestä johtuva sisäisten vesikammioiden muodostus), vetysidokset, ionisidokset (suolasilmukat), van der Waals -vuorovaikutukset, rikkisilta- eli disulfidisidokset sekä metalli-ionien koordinaatiot. Entropia ja entalpia kilpailevat siten, että natiivi tila on yleensä termodynaamisesti edullisin (vähintään paikallinen minimaali).
Taittumisen dynaamiikka ja malli
Proteiinin taittuminen ei aina ole yksinkertainen yhden reitin prosessi. Nykyinen kuva on niin sanottu taittumislaakso (folding funnel) -malli: polypeptidi liikkuu energiapinnalla kohti natiivia minimaalia monien mahdollisten välietappien kautta. Taittumisessa voi esiintyä molekyylisiä välivaiheita, kuten molten globule -tiloja, jotka ovat osittain järjestyneitä mutta eivät täysin stabiileja.
Auttavat tekijät solussa: lämmitys, avustajaproteiinit ja laadunvalvonta
Solussa taittumista tukevat ja ohjaavat mekanismit:
- Proteiinikarboboksi- ja lämpöshokkiproteiinit (esim. Hsp70, Hsp90, GroEL/GroES) toimivat chaperoneina — ne estävät epäspesifistä aggregoitumista ja auttavat proteiineja saavuttamaan natiivin konformaationsa.
- Eukaryooteilla endoplasmakalvoston (ER) laadunvalvonta ohjaa erityisesti salpa- ja eriterakenteita; väärin taittuneet proteiinit kohdistetaan takaisin taittumiseen tai hajoitetaan ubiquitin-proteasomi -järjestelmän kautta.
- Entsyymit kuten protein disulfide isomerase ja peptidyl-prolyl isomerase auttavat rikkisiltojen muodostuksessa ja proliiniresidujen cis/trans-isomerisoinnissa.
Väärintaittuminen ja sairaudet
Kun proteiini ei saavuta natiivia muotoa, seurauksena voi olla toiminnan menetys, aggregaatio tai toksiset oligomeerit. Tällaiset ilmiöt liittyvät moniin vakaviin sairauksiin, esimerkiksi:
- Neurodegeneratiiviset taudit: Alzheimerin tauti (amyloidibeetat), Parkinsonin tauti (α-synukleiini), Huntingtonin tauti (polyglutamiinin aggregation).
- Prionitaudit: vääntynyt prioniproteiini kykenee indusoimaan muiden saman proteiinin väärintaittumisen.
- Perinnölliset väärintaittumissairaudet: esim. cystic fibrosis, jossa CFTR-proteiinin väärä taittuminen estää sen normaalin funktion.
Solut yrittävät suojautua laadunvalvonnalla, mutta ylikuormitus voi johtaa solun stressitilaan ja unfolded protein response -vasteeseen tai apoptoosiin.
Käytännön merkitys ja tutkimusmenetelmät
Proteiinien taittumisen ymmärtäminen on tärkeää lääketieteessä, bioteknologiassa ja perustutkimuksessa. Sovelluksia:
- Farmakologiset stabilisaattorit ja "pharmacological chaperones" auttavat palauttamaan väärin taittuneiden proteiinien toimintaa.
- Rekombinanttiproteiinien tuotannossa osa proteiineista vaatii kontrolloitua uudelleentaittamista (refolding) yksiköistä tai inkluusiorakkuloista.
- Rokote- ja vasta-ainekehitys hyötyvät tiedosta, miten antigeeniset epitopit ovat esillä eri kolmiulotteisissa muodoissa.
Tyypillisiä tutkimusmenetelmiä taittumisen ja rakenteiden selvittämiseksi ovat röntgenkristallografia, NMR-spektroskopia ja kryo-elektronimikroskopia; kineettistä käyttäytymistä tutkitaan esimerkiksi fluoresenssi-, FRET- ja circular dichroism (CD) -menetelmillä sekä hydrogen–deuterium exchange -massaspektrometrialla. Viime vuosina laskennalliset ennustusmenetelmät, kuten koneoppimispohjaiset mallit (esim. AlphaFold), ovat merkittävästi parantaneet kykyä ennustaa rakenteita aminohapposekvenssistä.
Yhteenveto
Proteiinien taittuminen on välttämätön prosessi, jossa polypeptidiketjun aminohappojärjestys määräytyy vuorovaikutusten ja fysikaalisten voimien kautta toiminnalliseksi kolmioulotteiseksi rakenteeksi. Solun apujärjestelmät auttavat taittumista ja poistavat virheellisesti taittuneet molekyylit; kun nämä mekanismit pettävät, seurauksena voi olla sairauksia ja solumyrkyllisyyttä. Taittumisen tutkimus yhdistää fysiikkaa, kemiaa, biologiaa ja laskentamenetelmiä käytännön sovelluksiin lääketieteessä ja bioteknologiassa.
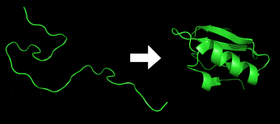
Proteiini ennen ja jälkeen taittamisen
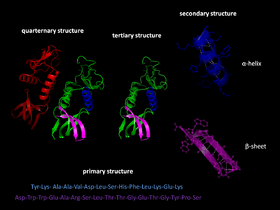
Proteiinien taittuminen on kolmas vaihe proteiinien rakenteen kehityksessä.
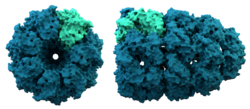
Chaperoniinin rakenne. Chaperoniinit avustavat joidenkin proteiinien taittumista.
Chaperones
Chaperoniinit ovat suuria proteiineja, jotka auttavat joidenkin proteiinien taittumista synteesin jälkeen. Chaperoniinit yleensä havaittiin ensimmäisen kerran auttavan histoneja ja DNA:ta liittymään yhteen ja muodostamaan nukleosomeja. Nukleosomit ovat kromosomien rakennuspalikoita. Nyt on selvää, että monet solun organellit rakentuvat tällä tavoin.
Kysymyksiä ja vastauksia
K: Mitä on proteiinien taittuminen?
V: Proteiinien taittuminen on prosessi, jossa polypeptidiketju muuttuu aminohapoista koostuvasta lineaarisesta ketjusta sille ominaiseksi kolmiulotteiseksi muodoksi.
K: Mikä pitää rakenteen kasassa?
V: Taitetun proteiinin rakennetta pitävät koossa vetysidokset.
K: Mitkä ovat proteiinin taittumisen vaiheet?
V: Proteiinien taittumisen vaiheisiin kuuluu, että kun mRNA:sta käännetään lineaariseksi aminohappoketjuksi, polypeptidi tai satunnaiskierukka on taittumaton ja vuorovaikutuksessa toistensa kanssa tuottaa hyvin määritellyn kolmiulotteisen rakenteen, jota kutsutaan natiiviksi tilaksi.
K: Mitä tapahtuu, jos proteiinit eivät taitu oikein?
V: Jos proteiinit eivät taitu natiiviin muotoonsa, ne ovat inaktiivisia ja yleensä myrkyllisiä. Tämä voi johtaa useisiin sairauksiin ja allergioihin, jotka johtuvat väärin taitetuista proteiineista, joita immuunijärjestelmä ei tunnista.
K: Kuka ratkaisi proteiinien laskostumisongelman vuonna 2020?
V: 30. marraskuuta 2020 proteiinien taittumisen ratkaisi tekoälyyritys DeepMind.
K: Mikä on Anfinsenin dogma? V: Anfinsenin dogman mukaan taitetun proteiinin tuloksena syntyvä kolmiulotteinen rakenne määräytyy sen aminohapposekvenssin perusteella.
Etsiä