Anfinsenin dogma: proteiinin taittumisen periaate ja poikkeukset
Anfinsenin dogma selitetty, proteiinin taittuminen aminohapposekvenssin mukaan, Levinthalin paradoksi, chaperonit ja poikkeukset kuten prionit ja amyloiditaudit
Anfinsenin dogma on Christian Anfinsenin esittämä hypoteesi molekyylibiologiassa. Ajatuksena on, että proteiinin taittuminen natiivirakenteeseensa tapahtuu automaattisesti proteiinin aminohapposekvenssin perusteella. Se pitää paikkansa vain joidenkin proteiinien kohdalla. Muihin proteiineihin tarvitaan chaperoneja.
Anfinsen sai vuonna 1972 Nobelin kemianpalkinnon ribonukleaasi A -entsyymin rakennetta koskevasta työstään. Dogman mukaan natiivirakenne on ainutlaatuinen ja stabiili tila olosuhteissa, joissa taittuminen tapahtuu. Olosuhteita on kolme:
ainutlaatuisuus
edellyttää, että sekvenssillä ei ole mitään muuta vastaavalla vapaalla energialla varustettua konfiguraatiota.
vakaus
pienet muutokset ympäröivässä ympäristössä eivät voi aiheuttaa muutoksia vähimmäiskokoonpanossa.
kineettinen saavutettavuus
tarkoittaa sitä, että lopullinen muoto saadaan ilman erittäin monimutkaisia muodonmuutoksia (kuten esimerkiksi solmuja).
Se, miten proteiini saavuttaa tämän rakenteen, on proteiinien taittumisen aihe, johon liittyy myös Levinthalin paradoksi. Levinthalin paradoksin mukaan tietyn proteiinin käytettävissä olevien mahdollisten konformaatioiden määrä on tähtitieteellisen suuri, niin että jopa pieni, 100 jäännöstä sisältävä proteiini vaatisi enemmän aikaa kuin maailmankaikkeudessa on ollut aikaa tutkia kaikki mahdolliset konformaatiot (10^26 sekuntia) ja valita sopiva konformaatio.
Prionit ovat poikkeus Anfinsenin dogmasta. Prionit ovat proteiinien stabiileja konformaatioita, jotka poikkeavat natiivista taittumistilasta. Naudan spongiformisessaenkefalopatiassa (hullun lehmän tauti) natiivit proteiinit taittuvat uudelleen erilaiseksi stabiiliksi konformaatioksi, mikä aiheuttaa kuolemaan johtavan amyloidikertymän. Muut amyloiditaudit, kuten Alzheimerin tauti ja Parkinsonin tauti, ovat myös poikkeuksia Anfinsenin dogmasta.
Lisätietoa Anfinsenin dogmasta ja sen tulkinnoista
Anfinsenin dogmaa kutsutaan myös termodynaamiseksi hypoteesiksi: natiivirakenne vastaa sekvenssille alinta vapaata energiaa tiettyjen olosuhteiden vallitessa. Tämä ei tarkoita, että proteiinit hakisivat satunnaisesti kaikkia mahdollisia konformaatioita — nykytulkinnassa taittuminen kuvataan ennemminkin energiamaiseman (folding funnel) avulla, jossa erilaiset paikalliset vuorovaikutukset ja energiasuppilot ohjaavat ketjua kohti oikeaa rakennetta.
Taittumisen mekanismit
Proteiinin taittumiseen vaikuttavat useat tekijät:
- Paikalliset sidokset ja vuorovaikutukset: hydrofobiset efektit, vetysidokset, elektrostaiset vuorovaikutukset ja van der Waals -voimat ohjaavat sekundääri- ja tertiäärirakenteen muodostumista.
- Disulfidisillat: kysteiinien välisten rikkisillojen muodostuminen voi ohjata tai stabiloida lopullista rakennetta. Solussa tähän auttaa protein disulfide isomerase (PDI).
- Kineettiset tekijät: taittuminen tapahtuu usein vaiheittain, ja tietyt väliasteet sekä isomerisaatiot (esim. peptidyl-prolyyli-isomerisaasit) voivat rajoittaa nopeutta.
- Ko- ja post-translationaalinen vaikutus: proteiinit voivat alkaa taittua jo ribosomilla co-translationally, ja liitännäiset kofaktorit tai kemialliset modifikaatiot (fosforylaatio, glykosylaatio) vaikuttavat lopulliseen muotoon.
- Kelluvuus ja molekyylinen ympäristö: solunsisäinen tilavuus, makromolekulaarinen ahtaustila (macromolecular crowding) ja pidättävät pinnat (kalvot, ribosomit) muokkaavat taittumista verrattuna in vitro -olosuhteisiin.
Chaperonit ja muut avustajat
Monet proteiinit tarvitsevat soluissa apua saavuttaakseen oikean rakenteen tai välttääkseen aggregaatiota. Tähän osallistuvat muun muassa:
- Heat shock -proteiinit (Hsp70, Hsp90): sitoutuvat avonaisiin polypeptidiketjuihin ja estävät epätarkoin muodostuvien väliasteiden aggregaatiota.
- Chaperoniinit (esim. GroEL/GroES): tarjoavat eristetyn "kotelon", jossa yksittäinen polypeptidi voi taittua ilman ulkopuolista interferenssiä.
- Foldaasit ja isomeraasit: kuten PDI ja peptidyl-prolyl isomerases, jotka katalysoivat tärkeitä kemiallisia reaktioita ja isomerisaatioita taittumisen aikana.
Levinthalin paradoksin ratkaisu
Levinthalin paradoksi korosti, ettei täydellinen satunnainen konformaatioiden läpikäynti selitä luonnollista taittumista. Nykyään ymmärretään, että energiamaisema ei ole tasainen: olemassa on lukuisia ohjattuja polkuja ja paikallisia minimaaleja, jotka johtavat nopeasti natiivirakenteeseen ilman koko konformaatiotilan eksplisiittistä läpikäyntiä. Tämän takia pienet proteiinit voivat refoldautua in vitro ilman apuja, kun taas suuremmat tai monimutkaisemmat vaativat usein chaperonien tukea.
Poikkeukset ja kliiniset merkitykset
Kuten mainittu, prionit ja amyloidisairaudet ovat esimerkkejä siitä, että proteiinit voivat siirtyä stabiiliin, ei-natiiviin konformaatioon, joka voi katalysoida muiden samanlaisten proteiinien muuttumisen samaan haitalliseen muotoon. Tällaiset tapahtumat liittyvät vakaviin neurodegeneratiivisiin tauteihin.
Yhteenveto ja merkitys
Anfinsenin dogma oli käänteentekevä ajatusproteinien rakenne-tutkimukselle: aminohapposekvenssissä on olennaista informaatiota oikean rakenteen muodostumiselle. Samalla käytännön biologia osoittaa, että solun monimutkainen ympäristö ja proteiinien koko/monimutkaisuus määräävät, tarvitaanko lisäavustajia. Anfinsenin periaate toimii perustavana lähtökohtana, mutta täydellisen kuvan saamiseksi on huomioitava kineettiset, kineettis–termodynaamiset ja solun kontekstuaaliset tekijät.
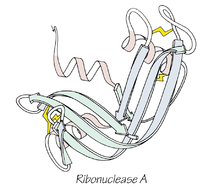
Ribonukleaasi A:n taitettu, kolmiulotteinen rakenne.
Kysymyksiä ja vastauksia
K: Mikä on Anfinsenin dogmi?
A: Anfinsenin dogma on Christian Anfinsenin esittämä molekyylibiologian hypoteesi, jonka mukaan proteiinin taittuminen natiivirakenteeseensa tapahtuu automaattisesti proteiinin aminohapposekvenssin perusteella.
K: Mitkä ovat kolme ehtoa ainutlaatuisuudelle, stabiilisuudelle ja kineettiselle saavutettavuudelle?
V: A: Ainutlaatuisuus edellyttää, että sekvenssillä ei ole mitään muuta konfiguraatiota, jolla olisi vastaava vapaa energia. Vakaus tarkoittaa, että pienet muutokset ympäröivässä ympäristössä eivät voi aiheuttaa muutoksia minimikonfiguraatiossa. Kineettinen saavutettavuus tarkoittaa, että lopullinen muoto voidaan saada ilman, että muodon muutokset ovat erittäin monimutkaisia (kuten esimerkiksi solmut).
Kysymys: Mikä on Levinthalin paradoksi?
V: Levinthalin paradoksin mukaan tietyn proteiinin käytettävissä olevien mahdollisten konformaatioiden määrä on tähtitieteellisen suuri, niin että jopa pieni 100 jäännöksen proteiini vaatisi enemmän aikaa kuin maailmankaikkeudessa on ollut olemassa kaikkien mahdollisten konformaatioiden tutkimiseen (1026 sekuntia) ja sopivan konformaation valitsemiseen.
K: Onko Anfinsenin dogmiin olemassa poikkeuksia?
V: Kyllä, prionit ja amyloiditaudit, kuten naudan spongiforminen enkefalopatia (hullun lehmän tauti), Alzheimerin tauti ja Parkinsonin tauti, ovat poikkeuksia Anfinsenin dogmasta.
K: Miten Christian Anfinsen sai Nobel-palkintonsa?
V: Christian Anfinsen sai kemian Nobel-palkintonsa työstään ribonukleaasi A -entsyymin rakenteen selvittämiseksi.
K: Miten prionit eroavat natiivista taittumistilasta?
V: Prionit ovat proteiinien stabiileja konformaatioita, jotka eroavat natiivista taittumistilasta.
Etsiä