Karbokationi
Karbokationi on ioni, jossa on positiivisesti varautunut hiiliatomi. Karbokationin varautunut hiiliatomi on "sekstetti" (eli sillä on vain kuusi elektronia ulommassa valenssikuoressaan kahdeksan valenssielektronin sijasta). Hiiliatomeilla, joilla on kahdeksan valenssielektronia, on suurin stabiilisuus (oktettisääntö). Siksi karbokationit ovat usein reaktiivisia ja pyrkivät täyttämään kahdeksikon valenssielektronien määrän sekä saamaan neutraalin varauksen takaisin. Logiikan mukaan karbokationilla on 3sp-hybridisaatio, jossa tyhjä 3sp-orbitaali antaa positiivisen varauksen. Karbokationin reaktiivisuus muistuttaa kuitenkin enemmän 2sp-hybridisaatiota trigonaalisen tasomaisen molekyyligeometrian kanssa.
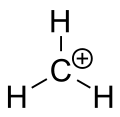
Metaanin karbeniumioni

tert-butyylikationi, joka osoittaa planaarista geometriaa
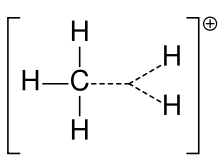
Metaanin karboniumioni
Määritelmät
Karbokationia kutsuttiin aiemmin usein karboniumioniksi, mutta kemistit kyseenalaistavat sen tarkan merkityksen. Nykyisessä kemiassa karbokationi on mikä tahansa positiivisesti varautunut hiiliatomi. On ehdotettu kahta erityyppiä: karbeniumionit ovat kolmiarvoisia ja karboniumionit viisi- tai kuusiarvoisia. Yliopistotason oppikirjoissa karbokationeista puhutaan vain ikään kuin ne olisivat karbeniumioneja, tai karbokationeista puhutaan ohimennen viitaten vanhempaan ilmaisuun karboniumioni tai karbenium- ja karboniumionit. Eräässä oppikirjassa käytetään vielä tänäkin päivänä karbeniumionille vanhempaa nimitystä karboniumioni ja varataan sanonta hypervalentti karbeniumioni CH5+:lle.
Historia
Vuonna 1891 G. Merling kertoi lisänneensä bromia tropylideeniin (sykloheptatrieeniin) ja lämmittäneensä tuotetta saadakseen kiteisen, vesiliukoisen aineen, C
7H
7Br. Hän ei ehdottanut sille rakennetta; Doering ja Knox osoittivat kuitenkin vakuuttavasti, että kyseessä oli tropylium(sykloheptatrieni)bromidi. Tämän ionin ennustetaan olevan aromaattinen Hückelin säännön mukaan.
Vuonna 1902 Norris ja Kehrman havaitsivat toisistaan riippumatta, että väritön trifenyylimetanoli antoi syvän keltaisia liuoksia väkevässä rikkihapossa. Trifenyylimetyylikloridi muodosti vastaavasti oransseja komplekseja alumiini- ja tinakloridien kanssa. Vuonna 1902 Adolf von Baeyer havaitsi muodostuneiden yhdisteiden suolamaisen luonteen.

Hän kutsui värin ja suolan muodostumisen välistä suhdetta halokromiaksi, josta malakiitin vihreä on malliesimerkki.
Karbokaatiot ovat reaktiivisia välituotteita monissa orgaanisissa reaktioissa. Hans Meerwein kehitti tätä Julius Stieglitzin vuonna 1899 esittämää ajatusta edelleen vuonna 1922 tekemässään Wagner-Meerweinin uudelleenjärjestelyä koskevassa tutkimuksessa. Karbokaatioiden havaittiin osallistuvan myös NS1-reaktioon, E1-reaktioon ja uudelleenjärjestelyreaktioihin, kuten Whitmoren 1,2-siirtymään. Kemiallinen laitos ei halunnut hyväksyä karbokationin käsitettä, ja pitkään Journal of the American Chemical Society -lehti kieltäytyi julkaisemasta artikkeleita, joissa ne mainittiin.
Ensimmäisen NMR-spektrin stabiilista karbokationista liuoksessa julkaisivat Doering et al. vuonna 1958. Kyseessä oli heptametyylibentseenoniumioni, joka valmistettiin käsittelemällä heksametyylibentseeniä metyylikloridin ja alumiinikloridin kanssa. Stabiilin 7-norbornadienyylikationin valmistivat Story et al. vuonna 1960 reagoimalla norbornadienyylikloridia hopeatetrafluoroboraatin kanssa rikkidioksidissa -80 °C:ssa. NMR-spektri osoitti, että se oli ei-klassisesti silloitettu (ensimmäinen havaittu vakaa ei-klassinen ioni).
Vuonna 1962 Olah havaitsi tert-butyylikarbokationin suoraan ydinmagneettisella resonanssilla stabiilina lajina liuotettaessa tert-butyylifluoridia maagiseen happoon. Schleyer et al. raportoivat ensimmäisen kerran norbornyylikationin NMR-kuvauksen, ja Saunders et al. osoittivat sen käyvän läpi protonien häilyvyyttä esteen yli.
Ominaisuudet
Orgaanisessa kemiassa karbokationiin kohdistuu usein nukleofiilejä, kuten hydroksyyli- (OH-−) ioneja tai halogeeni-ioneja, jotka hyökkäävät nukleofiilisesti.
Karbokationit luokitellaan primaarisiin, sekundaarisiin tai tertiäärisiin riippuen ionisoituneeseen hiileen sitoutuneiden hiiliatomien lukumäärästä. Primäärisissä karbokationeissa ionisoituneeseen hiileen on sitoutunut yksi tai nolla hiiltä, sekundäärisissä karbokationeissa ionisoituneeseen hiileen on sitoutunut kaksi hiiltä ja tertiäärisissä karbokationeissa ionisoituneeseen hiileen on sitoutunut kolme hiiltä.
Karbokationin stabiilisuus kasvaa sitä mukaa, kun varausta kantavaan hiileen on sitoutunut alkyyliryhmiä. Tertiääriset karbokationit ovat vakaampia (ja muodostuvat helpommin) kuin sekundääriset karbokationit; primaariset karbokationit ovat erittäin epävakaita, koska vaikka ionisoituneet korkeamman asteen hiilet stabiloituvat hyperkonjugaation avulla, substituoimattomat (primaariset) hiilet eivät ole. Siksi NS1-reaktion ja E1-eliminoitumisreaktion kaltaisia reaktioita ei yleensä tapahdu, jos muodostuisi primaarinen karbokationi. Poikkeuksena tästä on se, että ionisoituneen hiilen vieressä on hiili-hiili-kaksoissidos. Tällaiset kationit, kuten allyylikationi CH=CH-CH22+ ja bentsyylikationi6 CH-CH52+, ovat vakaampia kuin useimmat muut karbokationit. Molekyylit, jotka voivat muodostaa allyyli- tai bentsyylikarbokationeja, ovat erityisen reaktiivisia.
Karbokationit käyvät läpi uudelleenjärjestelyreaktioita vähemmän stabiileista rakenteista yhtä stabiileiksi tai stabiilimmiksi rakenteiksi nopeusvakioilla, jotka ovat yli 109 sekuntia. Tämä seikka vaikeuttaa monien yhdisteiden synteesireittejä. Esimerkiksi kun 3-pentanolia kuumennetaan vesipitoisen HCl:n kanssa, alun perin muodostunut 3-pentyylikarbokationi järjestäytyy uudelleen 3-pentyylin ja 2-pentyylin tilastolliseksi seokseksi. Nämä kationit reagoivat kloridi-ionin kanssa tuottaen noin 1/3 3-klooripentaania ja 2/3 2-klooripentaania.
Joillakin karbokationeilla, kuten norbornyylikationilla, on enemmän tai vähemmän symmetrinen kolmen keskuksen sidos. Tällaisia kationeja on kutsuttu ei-klassisiksi ioneiksi. Energiaero "klassisten" karbokationien ja "ei-klassisten" isomeerien välillä on usein hyvin pieni, ja "klassisten" ja "ei-klassisten" rakenteiden väliseen siirtymiseen liittyy yleensä vain vähän tai ei lainkaan aktivaatioenergiaa. 2-butyylikarbokationin "ei-klassinen" muoto on pohjimmiltaan 2-buteenia, jossa protoni on suoraan hiili-hiili-kaksoissidoksen keskipisteen yläpuolella. "Epäklassiset" karbokationit olivat aikoinaan suuren kiistan kohteena. Yksi George Olahin suurimmista saavutuksista kemian alalla oli tämän kiistan ratkaiseminen.
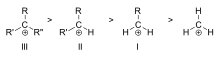
Esimerkkien tertiääristen (III), sekundääristen (II) ja primaaristen (I) alkyylikarbokationien stabiilisuusjärjestys
Erityiset karbokaatiot
Syklopropyylikarbinyylikationeja voidaan tutkia NMR:llä:

Dimetyylijohdannaisen NMR-spektrissä havaitaan kaksi ei-ekvivalenttia signaalia kahdelle metyyliryhmälle, mikä osoittaa, että tämän kationin molekyylikonformaatio ei ole kohtisuorassa (kuten A:ssa), vaan se on puolitettu (kuten B:ssä) siten, että tyhjä p-orbitaali ja syklopropyylirengassysteemi ovat samassa tasossa:

Taivutettujen sidosten teorian kannalta tämä etu selittyy olettamalla, että täytettyjen syklopropaanin taivutettujen sidosten ja tyhjän p-orbitaalin välillä on suotuisa orbitaalien päällekkäisyys.
Kysymyksiä ja vastauksia
K: Mikä on karbokationi?
A: Karbokationi on ioni, jossa on positiivisesti varautunut hiiliatomi.
K: Mikä on karbokationin ulompi valenssikuori?
V: Karbokationin ulommassa valenssikuoressa on vain kuusi elektronia stabiilin kahdeksan valenssielektronin sijasta.
K: Miksi karbokationit ovat usein reaktiivisia?
V: Karbokationit ovat usein reaktiivisia, koska ne pyrkivät täyttämään kahdeksikon valenssielektronien määrän ja saamaan neutraalin varauksen takaisin.
K: Mikä on hiiliatomien suurin stabiilisuus?
V: Hiiliatomien suurin stabiilisuus saavutetaan, kun niillä on kahdeksan valenssielektronia.
K: Mikä on sekstetti kemiassa?
V: Sekstetti on termi, jota käytetään kuvaamaan karbokationissa olevaa hiiliatomia, jonka ulommassa valenssikuoressa on vain kuusi elektronia stabiilin kahdeksan valenssielektronin sijasta.
K: Mikä on karbokationin hybridisaatio ja molekyyligeometria?
V: Vaikka logiikan mukaan karbokationit olisivat sp3-hybridisoituneita ja tyhjä sp3-orbitaali antaisi positiivisen varauksen, niiden reaktiivisuus muistuttaa enemmän sp2-hybridisoitumista ja trigonaalista planaarista molekyyligeometriaa.
K: Mikä on oktettisääntö?
V: Oktettisääntö on kemian periaate, jonka mukaan atomeilla on taipumus muodostaa toisten atomien kanssa kemiallisia sidoksia, jotka mahdollistavat sen, että molemmilla atomeilla on stabiili kahdeksan valenssielektronin joukko.
Etsiä