SN2-reaktio
SN 2 -reaktio (tunnetaan myös nimellä bimolekulaarinen nukleofiilinen substituutio) on orgaanisen kemian substituutioreaktio. Se on eräänlainen nukleofiilinen substituutio, jossa nukleofiilin yksinäinen pari hyökkää elektronipuutteiseen elektrofiiliseen keskukseen ja sitoutuu siihen. Tällöin toinen ryhmä, jota kutsutaan "poistuvaksi ryhmäksi", poistuu. Tuleva ryhmä korvaa siis lähtevän ryhmän yhdessä vaiheessa. Koska kaksi reagoivaa lajia osallistuu reaktion hitaaseen, nopeuden määräävään vaiheeseen, tästä käytetään nimitystä bimolekulaarinen nukleofiilinen substituutio tai SN 2. Epäorgaanisten kemistien keskuudessa SN 2 -reaktio tunnetaan usein vaihtomekanismina.
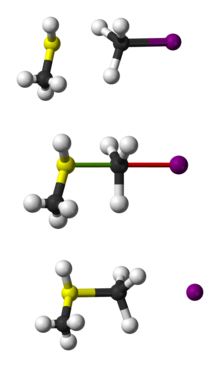
Pallo- ja sauvaesitys CH3 SH:n ja CH3 I:n SN 2 -reaktiosta SH:n ja CH I:n välillä.
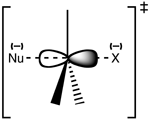
SN 2 -siirtymätilan rakenne.
Reaktiomekanismi
Reaktio tapahtuu useimmiten alifaattisessa sp3 hiilikeskuksessa, johon on liitetty elektronegatiivinen, stabiili poistuva ryhmä - "X" - usein halogenidiatomi. C-X-sidoksen katkeaminen ja uuden C-Nu-sidoksen muodostuminen tapahtuvat samanaikaisesti muodostaen siirtymätilan, jossa nukleofiilisen hyökkäyksen kohteena oleva hiili on pentakoordinaattinen ja suunnilleen sp2 hybridisoitunut. Nukleofiili hyökkää hiilen kimppuun 180°:n kulmassa poistuvaan ryhmään nähden, koska tällöin nukleofiilin yksinäisen parin ja C-X σ* -vastasidosorbitaalin päällekkäisyys on paras. Poistuva ryhmä työntyy sitten pois vastakkaiselta puolelta ja tuote muodostuu.
Jos nukleofiilisen hyökkäyksen kohteena oleva substraatti on kiraalinen, tämä voi johtaa, vaikkakaan ei välttämättä, stereokemian inversioon, jota kutsutaan Waldenin inversioksi.
Esimerkissä SN 2 -reaktiosta OH −(nukleofiili) ja bromietaani (elektrofiili) hyökkäävät toisiinsa, jolloin syntyy etanolia, ja bromidi poistuu poistuvana ryhmänä:
SN 2 -reaktio tapahtuu, jos molekyylin muut atomit eivät estä takapuolen hyökkäysreittiä (substraatin substituentit estävät sen steriilisti). Tämä mekanismi tapahtuu siis yleensä esteettömässä primäärisessä hiilikeskuksessa. Jos substraatti on steriilisesti ahtaalla lähtevän ryhmän lähellä, kuten tertiäärisessä hiilikeskuksessa, substituutio tapahtuu pikemminkin SN 1 kuin SN 2 -mekanismilla (SN 1 olisi myös todennäköisempi estyneiden molekyylien kohdalla, koska riittävän stabiili karbokationin välimuoto voisi muodostua).
Koordinaatiokemiassa assosiatiivinen substituutio tapahtuu samanlaisella mekanismilla kuin SN 2.
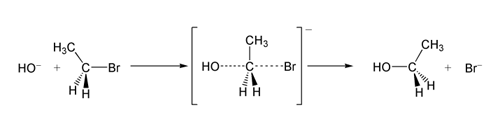
SN 2 bromietaanin reaktio hydroksidi-ionin kanssa.
Reaktion nopeuteen vaikuttavat tekijät
Neljä tekijää vaikuttaa reaktion nopeuteen:
- Alusta. Substraatti on tärkein tekijä reaktion nopeuden määrittämisessä. Tämä johtuu siitä, että nukleofiili hyökkää substraatin takaosasta, jolloin hiiltä jättävän ryhmän sidos katkeaa ja muodostuu hiili-nukleofiilisidos. SN 2 -reaktion nopeuden maksimoimiseksi substraatin takaosan on siis oltava mahdollisimman esteetön. Kaiken kaikkiaan tämä tarkoittaa, että metyyli- ja primääriset substraatit reagoivat nopeimmin, ja vasta sitten tulevat sekundääriset substraatit. Tertiääriset substraatit eivät osallistu SN 2 -reaktioihin steriittisten esteiden vuoksi.
- Nukleofiili. Kuten substraatin, myös nukleofiilin voimakkuuteen vaikuttaa steerinen este. Esimerkiksi metoksidi-anioni on sekä vahva emäs että nukleofiili, koska se on metyylinukleofiili ja siten hyvin esteetön. Tert-butoksidi taas on vahva emäs, mutta huono nukleofiili, koska sen kolme metyyliryhmää haittaavat sen lähestymistä hiileen. Nukleofiilin voimakkuuteen vaikuttavat myös varaus ja elektronegatiivisuus: nukleofiilisyys lisääntyy negatiivisen varauksen kasvaessa ja elektronegatiivisuuden vähentyessä. Esimerkiksi OH- on parempi nukleofiili kuin vesi, ja I- on parempi nukleofiili kuin Br- (polaarisissa protonisissa liuottimissa). Polaarisessa aprotisessa liuottimessa nukleofiliteetti kasvaa jaksollisen järjestelmän saraketta ylöspäin, koska liuottimen ja nukleofiilin välillä ei ole vetysidoksia. Tällöin nukleofiliteetti heijastaa emäksisyyttä. I- olisi siis heikompi nukleofiili kuin Br- , koska se on heikompi emäs.
- Liuotin. Liuotin vaikuttaa reaktionopeuteen, koska liuottimet voivat ympäröidä tai olla ympäröimättä nukleofiiliä ja siten estää tai olla estämättä sen lähestymistä hiiliatomiin. Napakat aprotiset liuottimet, kuten tetrahydrofuraani, ovat parempia liuottimia tähän reaktioon kuin napakat protoniset liuottimet, koska napakat protoniset liuottimet liukenevat liuottimen vetysidokseen nukleofiilin kanssa. Tämä estää sitä hyökkäämästä hiileen poistuvan ryhmän kanssa.
- Poistuva ryhmä. Poistuva ryhmä vaikuttaa reaktionopeuteen. Mitä stabiilimpi poistuva ryhmä on, sitä todennäköisemmin se ottaa hiilen jättävän ryhmän kaksi elektronia mukaansa, kun nukleofiili hyökkää hiileen. Siksi mitä heikompi poistuva ryhmä on konjugaattiemäksisenä, sitä parempi poistuva ryhmä. Vastaavasti, mitä vahvempi sitä vastaava happo on, sitä parempi poistuva ryhmä on. Esimerkkejä hyvistä poistuvista ryhmistä ovat halogenidit (paitsi fluoridi) ja tosylaatti. HO- ja H2 N- eivät kuitenkaan ole hyviä poistuvia ryhmiä.
Reaktiokinetiikka
SN 2 -reaktion nopeus on toisen kertaluvun reaktio, sillä nopeutta määräävä vaihe riippuu nukleofiilin pitoisuudesta [Nu− ] sekä substraatin pitoisuudesta [RX].
r = k[RX][Nu− ]
Tämä on keskeinen ero SN 1 ja SN 2 -mekanismien välillä. SN 1 -reaktiossa nukleofiili hyökkää nopeutta rajoittavan vaiheen jälkeen. Mutta SN 2 -reaktiossa nukleofiili pakottaa poistuvan ryhmän pois rajoittavassa vaiheessa. Toisin sanoen SN 1 -reaktioiden nopeus riippuu vain substraatin konsentraatiosta, kun taas SN 2 -reaktion nopeus riippuu sekä substraatin että nukleofiilin konsentraatiosta. Tapauksissa, joissa molemmat mekanismit ovat mahdollisia (esimerkiksi sekundaarisessa hiilikeskuksessa), mekanismi riippuu liuottimesta, lämpötilasta, nukleofiilin konsentraatiosta tai poistuvasta ryhmästä.
SN 2 -reaktioita suositaan yleensä primaarisissa alkyylihalogenideissa tai sekundaarisissa alkyylihalogenideissa, joissa on aprotinen liuotin. Tertiäärisissä alkyylihalogenideissa ne tapahtuvat vähäisessä määrin steeristen esteiden vuoksi.
SN 2 ja SN 1 ovat reaktioiden liukuvan asteikon kaksi ääripäätä. On mahdollista löytää monia reaktioita, joiden mekanismeissa on sekä SN 2 että SN 1 -luonne. Esimerkiksi alkyylihalogenidista on mahdollista saada muodostettua kontakti-ionipareja, joissa ionit eivät ole täysin erillään. Kun näissä tapahtuu substituutio, stereokemia kääntyy päinvastaiseksi (kuten SN 2:ssa) monissa reagoivissa molekyyleissä, mutta muutamissa saattaa konfiguraatio säilyä. SN 2 -reaktiot ovat yleisempiä kuin SN 1 -reaktiot.
E2 kilpailu
SN 2 -reaktioiden yhteydessä tapahtuva yleinen sivureaktio on E2-eliminaatio: tuleva anioni voi toimia emäksenä eikä nukleofiilinä, jolloin se poistaa protonin ja johtaa alkeenin muodostumiseen. Tämä vaikutus voidaan osoittaa sulfonaatin ja yksinkertaisen alkyylibromidin välisessä kaasufaasireaktiossa, joka tapahtuu massaspektrometrissä:

Etyylibromidin kanssa reaktiotuotteena on pääasiassa substituutiotuote. Kun elektrofiilisen keskuksen ympärillä oleva steriili este kasvaa, kuten isobutyylibromidin tapauksessa, substituutio ei edisty ja eliminaatio on vallitseva reaktio. Muita eliminaatiota suosivia tekijöitä ovat emäksen vahvuus. Vähemmän emäksisen bentsoaattisubstraatin kanssa isopropyylibromidi reagoi 55-prosenttisesti substituutiolla. Yleisesti ottaen tämäntyyppiset kaasufaasireaktiot ja liuosfaasireaktiot noudattavat samoja suuntauksia, vaikka ensin mainitussa reaktiossa liuottimen vaikutukset jäävät pois.
Kiertoliittymämekanismi
Vuonna 2008 huomiota herättänyt kehitys koskee SN 2 -kiertomekanismia, joka havaittiin kloridi-ionien ja metyylijodidin välisessä kaasufaasireaktiossa erityisellä tekniikalla, jota kutsutaan ristikkäisiksi molekyylisäteiksi. Kun kloridi-ionien nopeus on riittävä, syntyvien jodidi-ionien energia törmäyksen jälkeen on paljon odotettua pienempi, ja teorian mukaan energiaa menetetään metyyliryhmän täydellisen kiertoliikkeen seurauksena jodiatomin ympärillä ennen varsinaista siirtymistä.
Aiheeseen liittyvät sivut
- Substituutioreaktio
- SN 1 reaktio
Kysymyksiä ja vastauksia
K: Mikä on SN2-reaktio?
A: SN2-reaktio on orgaanisen kemian substituutioreaktio, jossa nukleofiili hyökkää elektronivajeisen elektrofiilisen keskuksen kimppuun karkottaen poistuvan ryhmän ja korvaten sen sitten yhdessä vaiheessa.
K: Millainen substituutioreaktio on SN2-reaktio?
V: SN2-reaktio on eräänlainen nukleofiilinen substituutioreaktio.
K: Kuinka monta reagoivaa lajia on mukana SN2-reaktion hitaassa, nopeutta määräävässä vaiheessa?
V: SN2-reaktion hitaaseen, nopeutta määräävään vaiheeseen osallistuu kaksi reagoivaa lajia.
K: Mitä tarkoittaa SN2-reaktion nimi "bimolekulaarinen nukleofiilinen substituutio"?
V: SN2-reaktion nimi "bimolekulaarinen nukleofiilinen substituutio" viittaa siihen, että kaksi reagoivaa lajia osallistuu reaktion hitaaseen, nopeuden määräävään vaiheeseen.
K: Mikä on nukleofiili SN2-reaktion yhteydessä?
V: Nukleofiili on molekyyli tai ioni, joka luovuttaa yksinäisen elektroniparin kemiallisen sidoksen muodostamiseksi.
K: Mikä on elektrofiili SN2-reaktion yhteydessä?
V: Elektrofiili on molekyyli tai ioni, joka ottaa vastaan elektroniparin muodostaakseen kemiallisen sidoksen.
K: Millä nimellä SN2-reaktio tunnetaan usein epäorgaanisten kemistien keskuudessa?
V: Epäorgaanisten kemistien keskuudessa SN2-reaktio tunnetaan usein vaihtomekanismina.
Etsiä