Cheletropinen reaktio – perisyklinen reaktio, jossa yksi atomi saa kaksi sidosta
Cheletropinen reaktio — perisyklinen mekanismi, jossa yksi atomi muodostaa kaksi sidosta. Lue selitys, esimerkit ja reaktion merkitys kemiassa.
Cheletropinen reaktio (suom. keletrooppinen reaktio) on eräänlainen perisyklinen reaktio, jossa yksi reagenssin atomi saa kaksi uutta sidosta samanaikaisesti tai vastaavasti yksi atomi menettää kaksi sidosta concerted-mekanismilla. Perisyklinen reaktio tarkoittaa reaktiota, jonka siirtymätilassa on syklinen joukko atomeja ja niihin liittyvä syklinen joukko vuorovaikutuksessa olevia orbitaaleja; tässä syklisessä järjestelyssä tapahtuu σ- ja π-sidosten uudelleenjärjestelyä.
Keletrooppiset reaktiot muodostavat sykladition alaluokan. Niiden erottava piirre on se, että molemmat uudet tai katkenneet sidokset liittyvät samaan atomiyksikköön. Tällaiset reaktiot voivat olla lisäysreaktioita, joissa yksittäinen atomifragmentti (esim. karbeni) muodostaa kaksi sidosta orgaaniseen molekyyliin, tai niin kutsuttuja ekstrusio-reaktioita, joissa esimerkiksi pieni molekyyli irtoaa ja jäljelle jäävä rakenne palautuu konjugoituneempaan muotoon.
Tyypillisiä esimerkkejä
- Keletrooppinen lisäys: karbeenien (esim. dichlorocarbenen) additio alkeenien tai konjugoituneiden dienien kanssa, jolloin karbeenin hiili muodostaa samanaikaisesti kaksi sidosta ja syntyy esimerkiksi sykloprooppirengas.
- Keletrooppinen ekstrusio: reaktiot, joissa irtoaa pieni stabiili molekyyli, kuten hiilimonoksidi (CO) tai typpi (N2), ja yhden atomin kaksi sidosta katkeavat concerted-tavalla. Näitä ekstrusioita kutsutaan usein keletrooppisiksi ekstrusioiksi; liikkeellepanevana voimana on tyypillisesti vapautuvan kaasun tuoma entrooppinen hyöty.
- Retro- ja peräkkäiset reaktiot: joissakin retro-sykladditioissa kaksi sidosta voidaan katkaista samalta atomilta muodostaen pienen molekyylin tai irrallisen atomifragmentin.
Orbitaalinen näkökulma ja säännöt
Keletrooppiset reaktiot ovat concerted-reaktioita, joten niiden kulku ja stereokemiallinen tulos määräytyvät orbitaalien symmetrian perusteella. Woodward–Hoffmannin periaatteet pätevät: reaktion sallitsevuus (allowed/forbidden) riippuu osallistuvien elektronien määrästä ja siitä, tapahtuuko sidosten muodostuminen suprafaciaalisesti vai antarafaciaalisesti. Pienten atomien (esim. karbeenin) liittyessä saman atomin kautta sidosten muodostus tapahtuu tyypillisesti suprafaciaalisesti molemmilla sidoskohtauksilla, mutta poikkeuksia esiintyy erityisolosuhteissa tai fotokemiallisesti aktivoituneissa prosesseissa.
Käytännön merkitys ja sovellukset
Keletrooppisia reaktioita hyödynnetään orgaanisessa synteesissä muun muassa vaikeiden syklisten rakenteiden muodostamisessa (esim. syklopropaanien synteesi karbeenilisäyksillä) sekä haitallisten tai hankalien funktionaalisten ryhmien poistossa keletrooppisina ekstrusioina. Erityisesti ekstrusiot, joissa vapautuu CO tai N2, ovat tärkeitä, koska kaasun vapautuminen tekee reaktion termodynaamisesti suotuisammaksi.
Kokeellisesti keletrooppiset reaktiot näkyvät usein stereospecificiteettinä: konservoidut stereokemialliset suhteet lähtöaineen ja tuotteen välillä viittaavat concerted-mekanismiin. Reaktion nopeuteen ja selectiivisuuteen voivat vaikuttaa lämpötila, liuotin, katalyytit (esim. metalli‑karbeni-rajat) ja lähtöaineen konformaatio.
Yhteenveto
Keletrooppinen (cheletropinen) reaktio on erityistapaus perisyklisestä reaktiosta, jossa yksi atomi muodostaa tai katkaisee kaksi sidosta concerted-mekanismilla. Tällaiset reaktiot voidaan jakaa lisäyksiin (esim. karbeenilisäykset) ja ekstrusioihin (pienien molekyylien, kuten CO tai N2, irtoaminen). Niiden ymmärtäminen perustuu orbitaalisen symmetrian sääntöihin ja niillä on merkittäviä sovelluksia synteesikemiassa.
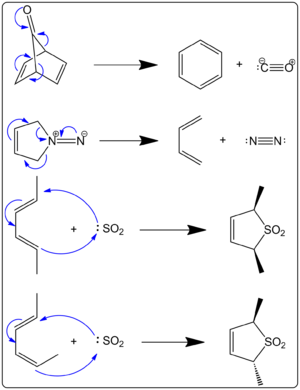
Kuva 1. Perisykliset reaktiot
Teoreettinen analyysi
Keletrooppisiin reaktioihin osallistuvien molekyylien geometrian vuoksi ne vahvistavat useita teoreettisten kemistien ennusteita. Keletrooppiset reaktiot vahvistavat molekyyliorbitaalien symmetrian säilymisen.
Perisyklisessä siirtymätilassa pieni molekyyli luovuttaa kaksi elektronia renkaalle. Kaksi mahdollista geometriaa voi selittää reaktion. Pieni molekyyli voi lähestyä joko lineaarisesti tai epälineaarisesti. Lineaarisessa lähestymistavassa pienen molekyylin orbitaalin elektronit kohdistuvat suoraan ison molekyylin π-järjestelmään. Epälineaarisessa lähestymistavassa orbitaali lähestyy hieman vinossa kulmassa. π-järjestelmän kyky kiertyä pienen molekyylin lähestyessä on ratkaisevan tärkeä uusien sidosten muodostamisessa. Pyörimissuunta on erilainen riippuen siitä, kuinka monta π-elektronia järjestelmässä on. Alla on esitetty kaavio kahden elektronin fragmentista, joka lähestyy neljän elektronin π-järjestelmää käyttäen rajamolekyyliorbitaaleja. Pyöriminen on disrotatiivista, jos pieni molekyyli lähestyy lineaarisesti, ja konrotatiivista, jos molekyyli lähestyy epälineaarisesti. Disrotatorinen ja konrotatorinen kertovat, miten π-järjestelmän sidokset pyörivät. Disrotatorinen tarkoittaa vastakkaisia suuntia, kun taas konrotatorinen tarkoittaa samaa suuntaa. Tämä näkyy myös alla olevassa kaaviossa.
Huckelin säännön avulla voidaan todeta, onko π-järjestelmä aromaattinen vai antiaromaattinen. Jos se on aromaattinen, lineaariset lähestymistavat käyttävät disrotatorista liikettä, kun taas epälineaariset lähestymistavat käyttävät konrotatorista liikettä. Antiaromaattisessa järjestelmässä asia on päinvastoin. Lineaarisissa lähestymistavoissa käytetään konrotatorista liikettä, kun taas epälineaarisissa lähestymistavoissa käytetään disrotatorista liikettä.
Keletrooppiset reaktiot, joissa on mukana SO2a
Termodynamiikka
Kun rikkidioksidi reagoi butadieenin ja isopreenin kanssa, syntyy kaksi erilaista tuotetta. Reaktiomekanismi määrää, mitä syntyy. Kineettinen tuote ja termodynaaminen tuote ovat molemmat mahdollisia. Termodynaamista tuotetta syntyy enemmän kuin kineettistä tuotetta. Kineettinen tuote syntyy Diels-Alder-reaktiossa, kun taas keletrooppisessa reaktiossa syntyy termodynaamisemmin stabiili tuote. Keletrooppista reittiä käytetään enemmän, koska se tuottaa vakaamman viisirenkaisen adduktin. Alla olevassa kaaviossa esitetään näiden kahden tuotteen välinen ero. Vasemmalla oleva polku osoittaa termodynaamisen tuotteen, kun taas oikealla oleva polku osoittaa kineettisen tuotteen. Suarez ja Sordo osoittivat tämän vuonna 1995. He osoittivat tämän sekä kokeellisesti että Gaussin laskelmien avulla.
Kinetiikka
Yksi esimerkki tästä on 1,3-dieenien keletrooppiset reaktiot rikkidioksidin kanssa. Kemistit ovat tutkineet huolellisesti tämän reaktion kinetiikkaa. Vuonna 1976 Isaacs ja Laila mittasivat kenettisiä tekijöitä rikkidioksidin lisäykselle butadieenijohdannaisiin. Additionopeuksia seurattiin bentseenissä 30 °C:ssa, jossa oli aluksi kaksikymmenkertainen ylijäämä dieeniä. He käyttivät spektrofotometriä, jolla tutkittiin valoa 320 nm:ssä SO2 katoamisen mittaamiseksi. Reaktio osoitti "pseudo ensimmäisen järjestyksen kinetiikkaa". Kemistit havaitsivat, että dieenin elektronia vetävät ryhmät vähensivät reaktionopeutta. Reaktionopeuteen vaikuttivat huomattavasti myös 2-substituenttien steriiliset vaikutukset, ja järeämmät ryhmät lisäsivät reaktionopeutta. (Toisin sanoen, mitä suurempi ryhmä atomeja roikkui toisesta hiiliatomista, sitä nopeammin reaktio sujui.) Kirjoittajat selittävät tämän bulkkisten ryhmien taipumuksella suosia dieenin cisoidista konformaatiota, joka on reaktion kannalta olennainen (ks. taulukko jäljempänä). Lisäksi mitattiin nopeudet neljässä lämpötilassa seitsemälle dieenille. Näiden mittausten perusteella kemistit laskivat Arrheniuksen yhtälön avulla kunkin reaktion aktivoitumisen entalpian (ΔH‡ ) ja aktivoitumisen entropian (ΔS‡ ). Tämä oli yksi ensimmäisistä tärkeistä pyrkimyksistä tutkia keletrooppisen reaktion kenetiikkaa.
| -Butadieeni | 104 k /min−1 (30 °C) (± 1-2 %) absoluuttinen arvo | 104 k /min−1 (30 °C) (± 1-2 %) suhteellinen | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-metyyli | 1.83 | 1.00 | 14.9 | -15 |
| 2-etyyli | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyyli | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyyli | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyyli | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromietyyli | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyyli | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyyli | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromifenyyli) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetyyli | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metyyli | 0.18 | 0.10 | N/A | N/A |
| trans-1-metyyli | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetyleenisykloheksaani | 24.7 | 13.5 | 11.4 | -16 |
| 2-metyyli-1,1,4,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel ja Sordo mittasivat vuonna 2002 rikkidioksidin lisäyksen kinetiikkaa 1,2-dimetyylideenisykloalkaaneihin. He kirjoittivat, että 1,2-dimetyylidylideenisykloheksaanin ja rikkidioksidin reaktiosta voi reaktio-olosuhteista riippuen syntyä kaksi erilaista tuotetta. Reaktiossa syntyy vastaava sulttiini hetero-Diels-Alder-reaktion kautta kineettisessä kontrollissa (≤ -60 °C), mutta termodynaamisessa kontrollissa (≥ -40 °C) reaktiossa syntyy vastaava sulfoleeni keletrooppisen reaktion kautta. Hetero-Diels-Alder-reaktion aktivointientalpia on noin 2 kcal/mol pienempi kuin vastaavan keletrooppisen reaktion. Sulfoleeni on noin 10 kcal/mol vakaampi kuin isometrinen sulttiini CH2 Cl /SO22 -liuoksessa.
Kirjoittajat pystyivät kokeellisesti laatimaan nopeuslain 261,2 K:n lämpötilassa 1,2-dimetyylideenisykloheksaanin ja rikkidioksidin reaktiolle, josta saadaan vastaava sulfoleeni. Reaktio oli ensimmäisen kertaluvun mukainen 1,2-dimetyylidylideenisykloheksaanissa mutta toisen kertaluvun mukainen rikkidioksidissa (ks. jäljempänä). Tämä vahvisti teoreettisten kemistien korkean tason ab initio-kvanttilaskelmiin perustuvan ennusteen. Kirjoittajat ehdottivat laskentamenetelmien avulla siirtymärakennetta 1,2-dimetyylideenisykloheksaanin ja rikkidioksidin keletrooppiselle reaktiolle (ks. kuva oikealla). Reaktio on rikkidioksidin suhteen toisen kertaluvun reaktio, koska toinen rikkidioksidimolekyyli todennäköisesti sitoutuu siirtymätilaan auttaakseen sen vakauttamisessa. Samankaltaisia tuloksia saatiin Suarezin, Sordon ja Sordon vuonna 1995 tekemässä tutkimuksessa, jossa käytettiin ab initio -laskelmia rikkidioksidin ja 1,3-dieenien välisen reaktion kineettisen ja termodynaamisen hallinnan tutkimiseen.
Liuottimen vaikutukset
Liuottimen vaikutusta 3,4-dimetyyli-2,5-dihydrotiofeni-1,1-dioksidin keletrooppiseen reaktioon (kuvassa oikealla) tutkittiin kineettisesti 14 liuottimessa. Eteen- ja taaksepäin suuntautuvan reaktion nopeusvakioiden sekä tasapainovakioiden havaittiin korreloivan lineaarisesti liuottimen polariteettiasteikon ET (30) kanssa.
Reaktiot suoritettiin 120 °C:ssa, ja niitä tutkittiin reaktioseoksen 1H-NMR-spektroskopialla. Etenemisnopeuden k1 havaittiin pienenevän 4,5-kertaiseksi sykloheksaanista metanoliin siirryttäessä. Käänteisnopeuden k-1 havaittiin kasvavan 53-kertaiseksi siirryttäessä sykloheksaanista metanoliin, kun taas tasapainovakio Keq pieneni 140-kertaiseksi. On oletettavaa, että polariteetti muuttuu aktivointiprosessin aikana, kuten tasapaino- ja kineettisten tietojen väliset suhteet osoittavat. Kirjoittajat toteavat, että reaktioon näyttää vaikuttavan liuottimen poolisuus, ja tämä voidaan osoittaa dipolimomenttien muutoksella siirryttäessä reaktantista siirtymätilasta tuotteeseen. Kirjoittajat toteavat myös, että keletrooppiseen reaktioon ei näytä vaikuttavan liuottimen happamuus tai emäksisyys.
Tämän tutkimuksen tulosten perusteella kirjoittajat odottavat seuraavia käyttäytymismalleja:
1. Liuottimen napaisuuden muutos vaikuttaa nopeuteen vähemmän kuin tasapaino.
2. Nopeusvakioille on ominaista päinvastainen vaikutus polariteetin suhteen: k1 pienenee hieman ET (30) kasvaessa ja k-1 kasvaa samoissa olosuhteissa.
3. Vaikutus k-1 on suurempi kuin k .1
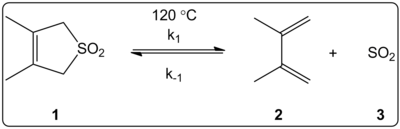
Keletrooppinen reaktio tutkittu eri liuottimissa
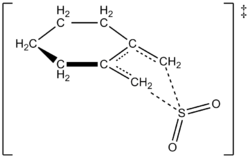
Ehdotettu siirtymätila 1,2-dimetyylideenisykloheksaanin ja SO2 välisessä reaktiossa sulfoleenin saamiseksi keletrooppisen reaktion avulla.
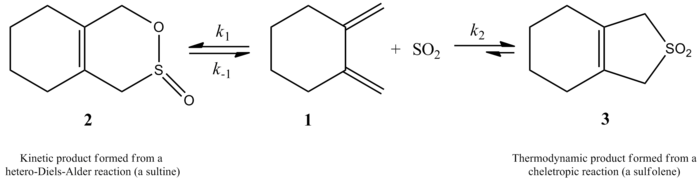
1,2-dimetyylideenisykloheksaanin ja SO2 reaktio, josta saadaan sultinia kineettisesti kontrolloidun hetero-Diels-Alder-reaktion avulla tai sulfoleenia termodynaamisesti kontrolloidun keletrooppisen reaktion avulla.
Karbeenien lisäykset alkeneihin
Yksi synteettisesti tärkeimmistä keletrooppisista reaktioista on singlettikarbeenin liittäminen alkeeniin syklopropaanin muodostamiseksi (ks. kuva vasemmalla). Karbeeni on neutraali molekyyli, joka sisältää kaksiarvoisen hiilen, jonka valenssikuoressa on kuusi elektronia. Tämän vuoksi karbeenit ovat erittäin reaktiivisia elektrofiilejä, ja niitä syntyy reaktion välituotteina. Singlettikarbeeni sisältää tyhjän p-orbitaalin ja suunnilleen sp2 hybridiorbitaalin, jossa on kaksi elektronia. Singlettikarbeenit liittyvät stereospesifisesti alkeeniin, ja alkeenin stereokemia säilyy syklopropaanituotteessa. Karbeenin additiomekanismi alkeeniin on koordinoitu [2+1]-sykladition mekanismi (ks. kuva). Kloroformista tai bromoformista peräisin olevia karbeneja voidaan käyttää CX2 -lisäykseen alkeeniin, jolloin saadaan dihalosyklopropania, kun taas Simmons-Smithin reagenssi lisää CH2 .
Täytetyn karbeeniorbitaalin vuorovaikutus alkeenin π-systeemin kanssa luo neljän elektronin systeemin ja suosii epälineaarista lähestymistapaa. On myös suotuisaa sekoittaa karbeenin tyhjä p-orbitaali ja täytetty alleenin π-orbitaali. Suotuisa sekoittuminen tapahtuu epälineaarisen lähestymistavan kautta (ks. kuva 2 oikealla). Vaikka teoria selvästi suosii epälineaarista lähestymistapaa, lineaarisen ja epälineaarisen lähestymistavan välillä ei kuitenkaan ole selviä kokeellisia vaikutuksia.
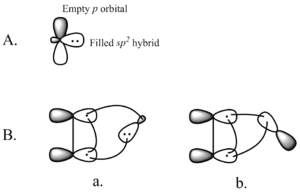
Kuva 2. A) Singlettikarbeenien orbitaalit B) Epälineaarinen lähestymistapa a) karbeenin sp-orbitaaliin2 ja b) karbeenin p-orbitaaliin.
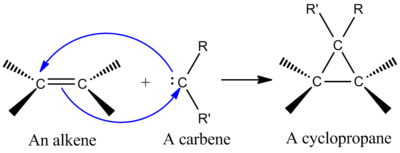
Karbeenin liittäminen alkeeniin syklopropaanin muodostamiseksi
Kysymyksiä ja vastauksia
K: Mikä on cheletrooppinen reaktio?
A: Keletrooppinen reaktio on eräänlainen perisyklinen reaktio, jossa yhden reagenssin yksi atomi saa kaksi uutta sidosta.
K: Mikä on perisyklinen reaktio?
V: Perisyklinen reaktio on reaktio, johon liittyy siirtymätila, jossa on syklinen joukko atomeja ja siihen liittyvä syklinen joukko vuorovaikuttavia orbitaaleja, ja jossa َ- ja ً-sidokset järjestäytyvät uudelleen.
K: Miten se eroaa muunlaisista reaktioista?
V: Keletrooppiset reaktiot ovat sykladitiotyyppien alaluokka, ja ne eroavat muista reaktiotyypeistä siinä, että yhdessä reagenssissa molemmat uudet sidokset muodostuvat samaan atomiin.
K: Mitkä ovat esimerkkejä?
V: Esimerkkejä ovat "keletrooppiset ekstrusoinnit", kuten silloin, kun karbonyyliryhmän yksi atomi päätyy hiilimonoksidiksi.
K: Mikä ajaa näitä reaktioita?
V: Näiden reaktioiden liikkeellepanevana voimana on usein kaasun (esim. CO tai N2) vapautumisesta saatava entrooppinen hyöty.
K: Liittyykö kuva 1 keletrooppisiin reaktioihin? V: Kyllä, kuvassa 1 on esimerkkejä keletrooppisista reaktioista.
Etsiä
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)