Jaksollinen järjestelmä: alkuaineet, ryhmät ja jaksot selitetty
Tutustu jaksolliseen järjestelmään: alkuaineiden järjestysluvut, jaksot ja ryhmät selitetty selkeästi — opi jalokaasuista, metalleista ja kemiallisista säännönmukaisuuksista.
Kemiallisten alkuaineiden jaksollinen järjestelmä on luettelo tunnetuista kemiallisista alkuaineista. Taulukossa alkuaineet on sijoitettu järjestykseen niiden järjestyslukujen mukaan alkaen pienimmästä luvusta yksi, vedystä. Alkuaineen järjestysluku on sama kuin protonien lukumäärä kyseisessä atomin ytimessä. Jaksollisessa järjestelmässä alkuaineet on järjestetty jaksoihin ja ryhmiin. Taulukon alkuaineita sisältävää riviä kutsutaan jaksoksi. Kullakin jaksolla on numero, joka on 1-8. Jaksossa 1 on vain kaksi alkuainetta: vety ja helium. Jaksossa 2 ja 3 on molemmissa 8 alkuaineita. Muut jaksot ovat pidempiä. Jakson alkuaineilla on peräkkäiset järjestysluvut.
Jaksojen pituudet ja elektronikuoret
Jaksojen pituudet määräytyvät elektronikuorien ja -orbitaleiden täyttymisen mukaan. Perussääntö on, että alkuaineet siirtyvät järjestyksessä elektronien täyttäessä s-, p-, d- ja f-orbitaleja. Jaksojen tyypilliset pituudet ovat:
- Jakso 1: 2 alkuaineetta (s-shell täyttyy: 1s2).
- Jaksot 2 ja 3: kummassakin 8 alkuaineetta (s- ja p-orbitaalit: 2s2 2p6 jne.).
- Jaksot 4 ja 5: kummassakin 18 alkuaineetta (s-, p- ja d-orbitaalit osin mukana).
- Jaksot 6 ja 7: tavallisesti 32 paikkaa, koska f-orbitaalit (lantanoidit ja aktinoidit) liittyvät näihin jaksoihin; käytännössä jakso 7 sisältää myös monia synteettisiä, lyhytikäisiä alkuaineita.
Ryhmä, valenssielektronit ja kemialliset ominaisuudet
Taulukossa olevaa alkuaineiden saraketta kutsutaan ryhmäksi. Tavallisessa jaksollisessa järjestelmässä on 18 ryhmää. Jokaisella ryhmällä on numero: 1-18. Ryhmään kuuluvien alkuaineiden elektronit ovat järjestäytyneet samalla tavalla valenssielektronien lukumäärän mukaan, mikä antaa niille samanlaiset kemialliset ominaisuudet (ne käyttäytyvät samalla tavalla). Esimerkiksi ryhmä 18 tunnetaan jalokaasuina, koska ne ovat kaikki kaasuja eivätkä yhdisty muiden atomien kanssa.
Valenssielektronit eli uloimmat elektronit määräävät, miten atomi reagoi kemiallisesti: s- ja p-lohkojen alkuaineilla valenssi on yleensä selkeä (esim. alkalimetallit ryhmässä 1: yksi valenssielektroni), kun taas siirtymämetalleilla (d-lohko) ja f-lohkon alkuaineilla esiintyy moninaisempia hapetusasteita.
Jaksollisen järjestelmän lohkot
Jaksollinen järjestelmä jaetaan usein lohkoihin elektroniorbitaalien perusteella:
- s-lohko: ryhmät 1–2 ja helium. Alkali- ja maa-alkalimetallit.
- p-lohko: ryhmät 13–18. Sisältää epämetallit, metalloidit ja osan metalleista.
- d-lohko: ryhmät 3–12; nämä ovat siirtymämetalleja, joilla on tyypillisesti monia hapetusasteita ja metallisia ominaisuuksia.
- f-lohko: lantanoidit ja aktinoidit, jotka usein sijoitetaan taulukon alle erikseen niiden samanlaisten kemiallisten ominaisuuksien vuoksi.
Kemialliset luokat ja trendit
Kemistit ovat käyttäneet jaksollista järjestelmää havaitakseen alkuaineiden välisiä malleja ja suhteita. Jaksollisessa järjestelmässä on kolme pääryhmää: metallit, metalloidit ja epämetallit. Esimerkiksi taulukon alareunassa ja äärimmäisenä vasemmalla olevat alkuaineet ovat kaikkein metallisimpia ja oikealla ylhäällä olevat alkuaineet ovat vähiten metallisia. (Esimerkiksi cesium on paljon metallisempi kuin helium).
Yleisimmät jaksolliset trendit, joita kemistit seuraavat, ovat:
- Atomisäde: kasvaa siirryttäessä ylhäältä alas samassa ryhmässä ja pienenee vasemmalta oikealle samassa jaksossa.
- Ionisaatioenergia: eli energiamäärä, joka tarvitaan elektronin poistamiseen; tyypillisesti kasvaa vasemmalta oikealle ja pienenee ylhäältä alas.
- Elektronegatiivisuus: atomin kyky vetää sidoselektroneja puoleensa; yleensä kasvaa vasemmalta oikealle ja pienenee ylhäältä alas.
- Hapetusasteet ja kemiallinen monimuotoisuus: siirtymämetalleilla ja f-lohkon alkuaineilla voi olla useita vakaita hapetusasteita, mikä tekee niistä kemiallisesti monipuolisia.
Erityistapaukset ja käytännön huomioita
- Vety: usein sijoitettu jakson alkuun, mutta sen kemialliset ominaisuudet eivät täysin sovi yhteen minkään yhden ryhmän kanssa — se voi käyttäytyä sekä metalleille että epämetalleille tyypillisellä tavalla.
- Helium:
- Lantanoidit ja aktinoidit: f-lohkon alkuaineet ovat usein sijoitettu taulukon alle; aktinoideista osa on luonnossa radioaktiivisia ja monet ovat synteettisiä.
- Synteettiset alkuaineet: järjestysluvun kasvaessa monet alkuaineet ovat lyhytikäisiä, radioaktiivisia ja valmistettu laboratoriossa (transuraanit, eli uraniumin jälkeen).
Historia ja tieteellinen merkitys
Jaksollisen järjestelmän keksi venäläinen kemisti Dmitri Ivanovitš Mendelejev (1834-1907). Hänen tunnetuin panoksensa oli järjestelmän laatiminen siten, että se korosti toistuvia kemiallisia ominaisuuksia ja jätti tarkoituksella aukkoja tuntemattomille alkuaineille — hän myös ennusti niiden ominaisuuksia ja löysi useimmiten oikeita arvoja myöhemmin löydetyille alkuaineille. Hänen kunniakseen alkuaine 101 nimettiin hänen mukaansa mendelejiksi.
Vuonna 1990 Kansainvälinen puhtaan ja soveltavan kemian liitto (IUPAC) päätti käyttää uutta arabialaisia numeroita sisältävää ryhmänumerointia 1–18 korvaamaan aiemmat roomalaisiin numeroihin perustuvat järjestelmät. Roomalaisia numeroita käytettiin aiemmin laajalti, mutta nykyään IUPACin 1–18-numerointi on standardi.
Miksi jaksollinen järjestelmä on tärkeä?
Jaksollinen järjestelmä tarjoaa kemisteille ja muille tieteilijöille tehokkaan työkalun alkuaineiden ominaisuuksien ennustamiseen, reaktioiden ymmärtämiseen ja materiaalien suunnitteluun. Se yhdistää atomien rakenteen (protonit, neutronit, elektronit) ja makroskooppiset kemialliset käyttäytymismallit systemaattiseksi kokonaisuudeksi, jota voidaan laajentaa uusilla löydöillä ja synteesillä.
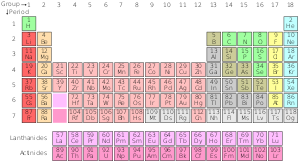
Jaksollisen järjestelmän vakiovariaatio
Tavallinen jaksollinen järjestelmä
| Ryhmä → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 14 | 15 | 16 | 17 | |||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanidit | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinidit | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superaktinidit | |||||||||||||||||
| * Lantanidisarja | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Aktinidisarja | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superaktinidisarja | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superaktinidisarja | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superaktinidisarja | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Superaktinidisarja | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Käyttö | 180Uon | |||||
| *** Superaktinidisarja | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superaktinidisarja | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superaktinidisarja | 211Buu | 212Bub | 213Mutta | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 miljardia | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Jaksollisen järjestelmän kemialliset sarjat
- Alkalimetallit
- Emäksiset maametallit
- Lantanidit
- Aktinidit
- Superaktinidit
- Siirtymämetallit
- Huonot metallit
- Ei-metallit
- Halogeenit
Tila vakiolämpötilassa ja -paineessa. Alkuaineen symbolin yläpuolella olevan numeron (atomiluku) väri osoittaa alkuaineen tilan normaaliolosuhteissa.
- sinisellä merkityt ovat kaasuja
- vihreällä värillä olevat ovat nesteitä
- mustalla merkityt ovat kiinteitä
- Niillä, joilla on kiinteät rajat, on stabiileja isotooppeja (alkuaineet).
- Katkoviivoitetuilla rajoilla on vain radioaktiivisia luonnossa esiintyviä isotooppeja.
- Ne, joissa on pistemäinen rajaus, eivät esiinny luonnossa (synteettiset alkuaineet).
- ne, joilla ei ole rajoja, ovat liian radioaktiivisia, jotta niitä olisi vielä löydetty.
Muut menetelmät kemiallisten alkuaineiden esittämiseksi
Edellä esitetty jaksollisen järjestelmän versio on eniten käytetty. Muut laajalle levinneet versiot esitetään jäljempänä:
· 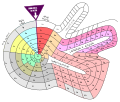
Theodor Benfey järjesti alkuaineet spiraalimaisesti vedyn ympärille. Atomipaino määrää alkuaineen sijainnin.
· 
Dmitri Ivanovitš Mendelejev käytti kukka-asettelua; aktinidit ja lantanidit on esitetty silmukoina pääryhmän vieressä.
· 
Timothy Stove järjesti alkuaineet kvanttiluvun mukaan.
· ![]()
Betterman järjesti alkuaineet niiden isoelektristen ominaisuuksien mukaan, jotka voidaan muuntaa polynomimuotoon.
· 
Zmaczynskin ja Bayleyn laatima kolmiomainen versio.
· 
Järjestetty pyramidiksi.
Vähemmän käytetyt versiot
- Vakiotaulukko sisältää perusasiat. Se on esitetty edellä
- Pystysuora taulukko parantaa luettavuutta verkkoselaimissa.
- Isossa taulukossa on perusasiat ja elementtien täydelliset nimet.
- Valtava taulukko sisältää perusasiat sekä alkuaineiden täydelliset nimet ja atomimassat.
- Elektronikonfiguraatiot
- Metallit ja muut kuin metallit
- Alkuaineluettelo: sisältää nimen, symbolin, järjestysluvun, atomimassan, ryhmän ja jakson; lajiteltavissa minkä tahansa näistä tekijöistä mukaan.
- Luettelo elementeistä symbolin mukaan
- Luettelo alkuaineista kiehumispisteen mukaan
- Luettelo alkuaineista sulamispisteen mukaan
- Luettelo alkuaineista tiheyden mukaan
Aiheeseen liittyvät sivut
- Jaksollisen järjestelmän ryhmä
- Jaksollisen järjestelmän jakso
- Laajennettu jaksollinen järjestelmä
Kysymyksiä ja vastauksia
Q: Mikä on jaksollinen järjestelmä?
A: Jaksollinen järjestelmä on kaavio, jossa kaikki tunnetut kemialliset alkuaineet on järjestetty niiden järjestyslukujen mukaisessa järjestyksessä alkaen vedystä, joka on numero yksi. Ominaisuuksiltaan samankaltaiset alkuaineet sijoitetaan usein lähelle toisiaan.
K: Kuinka monta jaksoa ja ryhmää on tavallisessa jaksollisessa järjestelmässä?
V: Standardisessa jaksollisessa järjestelmässä on 8 jaksoa ja 18 ryhmää.
K: Mitä yhteistä on jakson alkuaineilla?
V: Jakson alkuaineilla on peräkkäiset järjestysluvut.
K: Mitä yhteistä on ryhmän alkuaineilla?
V: Ryhmän alkuaineilla on elektronit järjestetty samalla tavalla valenssielektronien lukumäärän mukaan, mikä antaa niille samanlaiset kemialliset ominaisuudet.
K: Kuka keksi jaksollisen järjestelmän?
V: Jaksollisen järjestelmän keksi venäläinen kemisti Dmitri Ivanovitš Mendelejev (1834-1907).
K: Mitkä ovat jaksollisen järjestelmän kolme pääryhmää?
V: Jaksollisen järjestelmän kolme pääryhmää ovat metallit, metalloidit ja epämetallit.
K: Miten jaksollisen järjestelmän avulla voidaan havaita alkuaineiden välisiä kuvioita ja suhteita?
V: Alkuaineiden välisiä kuvioita ja suhteita voidaan havaita katsomalla, missä kohtaa jaksollista järjestelmää ne esiintyvät; esimerkiksi jaksollisen järjestelmän vasemmassa alareunassa olevat alkuaineet ovat yleensä metallisempia kuin oikealla ylhäällä olevat alkuaineet.
Etsiä