Happi (O): ominaisuudet, biologinen merkitys ja käyttö
Happi (O): ominaisuudet, biologinen merkitys ja käyttö — kattava opas hapen kemiasta, hengityksestä, otsonista sekä teollisista ja lääketieteellisistä sovelluksista.
Happi on kemiallinen alkuaine. Sen symboli on O ja järjestysluku 8. Se on maailmankaikkeuden kolmanneksi yleisin alkuaine vedyn ja heliumin jälkeen.
Happea on yli viidennes maapallon ilmakehän tilavuudesta. Ilmassa kaksi happiatomia yhdistyy yleensä diohapeksi (O
2), joka on väritön kaasu. Tätä kaasua kutsutaan usein vain hapeksi. Sillä ei ole makua eikä hajua. Nestemäisenä tai kiinteänä se on vaaleansinistä.
Happi kuuluu jaksollisen järjestelmän kalkogeeniryhmään. Se on erittäin reaktiivinen epämetalli. Se muodostaa oksideja ja muita yhdisteitä monien alkuaineiden kanssa. Näissä oksideissa ja muissa yhdisteissä (lähinnä silikaattimineraaleissa ja kalkkikiven kalsiumkarbonaatissa) oleva happi muodostaa massaltaan lähes puolet maankuoresta.
Useimmat elävät olennot käyttävät happea hengityksessä. Monissa elävien olentojen molekyyleissä, kuten proteiineissa, nukleiinihapoissa, hiilihydraateissa ja rasvoissa, on happea. Happi on osa vettä, jota kaikki tunnettu elämä tarvitsee elääkseen. Levät, syanobakteerit ja kasvit tuottavat maapallon happikaasua fotosynteesillä. Ne käyttävät auringon valoa saadakseen vedestä vetyä ja luovuttaakseen happea.
Maan ilmakehän yläosassa on otsonia (O
3), otsonikerroksessa. Se absorboi ultraviolettisäteilyä, minkä ansiosta maanpinnan tasolle pääsee vähemmän säteilyä.
Happikaasua käytetään teräksen, muovien ja tekstiilien valmistukseen. Sillä on myös lääketieteellisiä käyttötarkoituksia, ja sitä käytetään hengitykseen silloin, kun hyvää ilmaa ei ole (esimerkiksi sukeltajat ja palomiehet), sekä hitsaukseen. Nestemäistä happea ja happirikkaita yhdisteitä voidaan käyttää rakettien polttoaineena.
Perusominaisuudet
Happi on kaikille lääkeaineille ja useimmille biologisille prosesseille välttämätön alkuaine. Sen tärkeimpiä perusominaisuuksia:
- Atominumero: 8
- Atomimassa (vakio): noin 15,999
- Elektronirakenne: 1s² 2s² 2p⁴
- Normaali olomuoto: diatominen kaasu O
2 huoneenlämpötilassa - Kiehumispiste: noin −182,96 °C
- Sulamispiste: noin −218,79 °C
- Elektronegatiivisuus (Pauling): ~3,44
- Magneettiset ominaisuudet: O
2 on paramagneettinen (sillä on epäpareja elektroneja), mikä näkyy mm. magnetometreissä.
Allotrooppiset muodot ja isotoopit
Hapen yleisimmät allotrooppiset muodot ovat:
- Diohappi (O
2) – tavallinen hengityskaasu. - Otsoni (O
3) – voimakas hapetin, esiintyy luonnollisesti stratosfäärissä ja myös paikallisesti ilmakehässä; suojaa UV-säteilyltä mutta toimii maatasolla ilmanlaatuhaittana.
Merkittäviä hapen isotooppeja ovat 16O (n. 99,76 %), 17O ja 18O. Isotooppisuhteita käytetään mm. paleoklimatologiassa ja veden alkuperän tutkimuksessa.
Esiintyminen ja happikierto
Happi on maankuoren yleisin alkuaine massan mukaan: sen osuus on noin 46 % maankuoresta. Ilmakehässä happea on noin 21 % tilavuudesta. Suurin osa hapesta on sitoutuneena yhdisteisiin, erityisesti silikaatteihin ja karbonaatteihin.
Maapallon hapen kierto sisältää pääasiallisesti seuraavat prosessit:
- Fotosynteesi: kasvit, levät ja syanobakteerit tuottavat happea vapauttamalla sitä vedyksi irrotetusta vedestä.
- Respiraatio ja hapetusreaktiot: eliöt kuluttavat happea energiantuotannossa; hapettuminen muuttaa orgaanista ainesta ja mineraaleja.
- Geokemialliset prosessit: esimerkiksi veden ja kivien kemialliset reaktiot sitovat tai vapauttavat happea.
Biologinen merkitys
Happi on keskeinen osa soluhengitystä: monisoluiset eliöt hyödyntävät O
2 hapetuspelissä tuottamaan ATP:tä, jota solut käyttävät energiana. Vesi (H
2O) sisältää happea ja on elämän perusedellytys.
Lisäksi happi on rakenneosana useissa biologisissa molekyyleissä kuten proteiineissa, nukleiinihapoissa, hiilihydraateissa ja lipideissä. Ilmaston ja ekosysteemien toiminta liittyy vahvasti hapen virtauksiin.
Tuotanto ja teolliset käyttötavat
Teollisesti happea tuotetaan pääasiassa ilmaa jäähdyttämällä ja fraktionaalisesti tislaamalla (kriogeeninen erotus). Pienemmässä mittakaavassa käytetään myös paineen vaihtoon perustuvia menetelmiä (PSA) ja kemiallisia reaktioita.
Tärkeitä käyttökohteita:
- teräksen valmistus ja kaasutushitsaus
- lääketieteellinen happi hengitystä tukemaan
- vedenpuhdistus ja kemianteollisuuden hapetusprosessit
- nestemäinen happi (LOX) rakettien hapettimena
- polttoprosessit, hapen avulla saavutetaan korkeammat palamislämpötilat
Turvallisuus ja ympäristövaikutukset
Happi itsessään ei ole myrkyllinen, mutta hapeari ympäristö lisää huomattavasti palon vaarallisuutta: materiaalit syttyvät helpommin ja palavat voimakkaammin. Siksi happivarastointi ja -käyttö vaativat erityistä huolellisuutta.
Otsoni stratosfäärissä suojaa maapalloa UV-säteilyltä, mutta troposfäärin otsoni on ilmansaaste, joka haittaa hengitysteitä ja kasvien kasvua. Lisäksi hapetusprosesseilla on vaikutuksia biogeokemiallisiin kiertoihin ja paikalliseen ilmanlaatuun.
Lyhyt historia
Hapen havaitsemisesta ja ymmärtämisestä vastasivat 1700-luvulla useat tutkijat. Carl Wilhelm Scheele löysi kaasun itsenäisesti ja kuvaili sen ominaisuuksia ennen monia muita, mutta julkaisi tuloksensa myöhemmin. Joseph Priestley löysi ja eristi happea vuonna 1774. Antoine Lavoisier osoitti, että happi on alkuaine ja antoi sille nimen (kreikankielinen juurin merkitys liittyy "happamuuden muodostamiseen"), mikä muutti kemian käsityksiä pysyvästi.
Lopuksi
Happi on keskeinen elementti sekä elämälle että teollisuudelle. Sen reaktiivisuus tekee siitä korvaamattoman monissa kemiallisissa prosesseissa, mutta samalla se edellyttää huolellista käsittelyä turvallisuuden varmistamiseksi. Ymmärrys hapen roolista ekosysteemeissä, teollisuudessa ja ilmakehässä on tärkeää sekä ympäristönsuojelun että teknisen kehityksen kannalta.
Historia
Happikaasu (O
2) eristi Michael Sendivogius ennen vuotta 1604. Usein ajatellaan, että Carl Wilhelm Scheele löysi kaasun vuonna 1773 Ruotsissa tai Joseph Priestley vuonna 1774 Englannissa. Priestleytä pidetään yleensä pääasiallisena löytäjänä, koska hänen työnsä julkaistiin ensimmäisenä (vaikka hän kutsuikin kaasua "deflogistiseksi ilmaksi" eikä pitänyt sitä kemiallisena alkuaineena). Antoine Lavoisier antoi kaasulle nimen oxygène vuonna 1777. Hän oli ensimmäinen, joka sanoi sen olevan kemiallinen alkuaine. Hän oli myös oikeassa siinä, miten se auttaa palamista.
Varhaiset kokeet
Yhden ensimmäisistä tunnetuista kokeista siitä, miten palaminen tarvitsee ilmaa, suoritti kreikkalainen Philo Bysantista 2. vuosisadalla eaa. Hän kirjoitti teoksessaan Pneumatica, että astian kääntäminen ylösalaisin palavan kynttilän päälle ja veden laittaminen astian ympärille johti siihen, että osa vedestä meni astiaan. Filon mielestä tämä johtui siitä, että ilma muuttui klassiseksi elementiksi, tuleksi. Tämä on väärin. Kauan sen jälkeen Leonardo da Vinci selvitti, että palamisen aikana kului jonkin verran ilmaa, ja tämä pakotti vettä astiaan.
1600-luvun lopulla Robert Boyle havaitsi, että palamiseen tarvitaan ilmaa. Englantilainen kemisti John Mayow täydensi tätä osoittamalla, että tuli tarvitsi vain osan ilmasta. Kutsumme tätä nyt hapeksi (O2 ). Hän havaitsi, että suljetussa astiassa palava kynttilä sai veden nousemaan korvaamaan neljästoistaosan ilman tilavuudesta ennen kuin se sammui. Sama tapahtui, kun laatikkoon laitettiin elävä hiiri. Tästä hän päätteli, että happea käytetään sekä hengitykseen että palamiseen.
Flogiston-teoria
Robert Hooke, Ole Borch, Mihail Lomonosov ja Pierre Bayen käyttivät happea kokeissa 1600- ja 1700-luvuilla. Kukaan heistä ei pitänyt sitä kemiallisena alkuaineena. Tämä johtui luultavasti flogistoniteorian ajatuksesta. Tämä oli se, minkä useimmat uskoivat aiheuttavan palamisen ja korroosion.
J. J. Becher kehitti teorian vuonna 1667, ja Georg Ernst Stahl täydensi sitä vuonna 1731. Flogistoniteorian mukaan kaikki palavat aineet koostuivat kahdesta osasta. Toinen osa, jota kutsutaan flogistonniksi, vapautuu, kun sitä sisältävä aine palaa.
Materiaalien, kuten puun tai hiilen, joiden palamisesta jää hyvin vähän jäämiä, ajateltiin koostuvan pääasiassa flogistosta. Materiaalien, jotka syövyttävät, kuten rauta, ajateltiin sisältävän hyvin vähän. Ilma ei kuulunut tähän teoriaan.
Discovery
Puolalainen alkemisti, filosofi ja lääkäri Mikael Sendivogius kirjoitti jostakin ilmassa olevasta asiasta, jota hän kutsui "elämän ravinnoksi", ja tämä tarkoitti sitä, mitä me nykyään kutsumme hapeksi. Sendivogius havaitsi vuosien 1598 ja 1604 välillä, että ilmassa oleva aine on sama, jonka hän sai kuumentamalla kaliumnitraattia. Jotkut uskovat, että tämä oli hapen löytäminen, kun taas toiset ovat eri mieltä. Jotkut sanovat, että hapen löysi ruotsalainen farmaseutti Carl Wilhelm Scheele. Hän sai happea vuonna 1771 kuumentamalla elohopeaoksidia ja joitakin nitraatteja. Scheele kutsui kaasua "paloilmaksi", koska se oli ainoa kaasu, jonka tiedettiin mahdollistavan palamisen (kaasuja kutsuttiin tuolloin "ilmoiksi"). Hän julkaisi löytönsä vuonna 1777.
Elokuun 1. päivänä 1774 brittiläinen pappi Joseph Priestley keskitti auringonvalon elohopeaoksidiin lasiputkessa. Tästä kokeesta hän sai kaasua, jota hän kutsui "deflogistiseksi ilmaksi". Hän havaitsi, että kynttilät paloivat kirkkaammin kaasussa ja hiiri eli pidempään sitä hengittäessään. Kaasun hengittämisen jälkeen Priestley sanoi, että se tuntui normaalilta ilmalta, mutta hänen keuhkonsa tuntuivat sen jälkeen kevyemmiltä ja helpommilta. Hänen tutkimuksensa julkaistiin vuonna 1775. Koska hänen havaintonsa julkaistiin ensimmäisenä, hänen sanotaan usein keksineen hapen.
Ranskalainen kemisti Antoine Lavoisier sanoi myöhemmin, että hän oli myös löytänyt aineen. Priestley vieraili hänen luonaan vuonna 1774 ja kertoi hänelle kokeestaan. Scheele lähetti samana vuonna Lavoisierille myös kirjeen, jossa hän kertoi löydöstään.
Lavoisierin tutkimus
Lavoisier teki ensimmäiset tärkeimmät hapettumista koskevat kokeet. Hän oli ensimmäinen henkilö, joka selitti, miten palaminen toimii. Näiden ja muiden kokeiden avulla hän osoitti, että flogistoniteoria oli väärässä. Hän yritti myös todistaa, että Priestleyn ja Scheelen löytämä aine oli kemiallinen alkuaine.
Eräässä kokeessa Lavoisier havaitsi, että paino ei kasvanut, kun tina ja ilma lämmitettiin suljetussa astiassa. Hän havaitsi myös, että ilma virtasi sisään, kun astia avattiin. Tämän jälkeen hän havaitsi, että tinan paino oli kasvanut saman verran kuin sisään virtaavan ilman paino. Hän julkaisi havaintonsa vuonna 1777. Hän kirjoitti, että ilma koostuu kahdesta kaasusta. Toista hän kutsui "elintärkeäksi ilmaksi" (hapeksi), jota tarvitaan palamiseen ja hengittämiseen. Toista (typpeä) hän kutsui nimellä "azote", joka tarkoittaa kreikaksi "elotonta". (Tämä on edelleen typen nimi joillakin kielillä, myös ranskaksi).
Lavoisier nimesi "elintärkeän ilman" uudelleen "oxygène"-nimeksi, joka tulee kreikan sanoista, jotka tarkoittavat "hapon valmistusta" tai "hapon tuottajaa". Hän kutsui sitä näin, koska hän luuli hapen sisältyvän kaikkiin happoihin, mikä oli väärin. Myöhemmin kemistit ymmärsivät, että Lavoiserin kaasun nimi oli väärä, mutta nimi oli siihen mennessä liian yleinen muutettavaksi.
"Happi" tuli englanninkieliseksi nimeksi, vaikka englantilaiset tiedemiehet vastustivat sitä.
Myöhempi historia
John Daltonin atomiteorian mukaan kaikissa alkuaineissa oli yksi atomi ja yhdisteiden atomit olivat yleensä yksin. Hän esimerkiksi ajatteli virheellisesti, että veden (H2 O) kaava oli vain HO. Vuonna 1805 Joseph Louis Gay-Lussac ja Alexander von Humboldt osoittivat, että vesi koostuu kahdesta vetyatomista ja yhdestä happiatomista. Vuonna 1811 Amedeo Avogadro laski Avogadron lain perusteella oikein, mistä vesi koostuu.
1800-luvun loppupuolella tutkijat havaitsivat, että ilma voitiin muuttaa nesteeksi ja että siinä olevat yhdisteet voitiin eristää puristamalla ja jäähdyttämällä sitä. Sveitsiläinen kemisti ja fyysikko Raoul Pictet löysi nestemäisen hapen haihduttamalla rikkidioksidia hiilidioksidin muuttamiseksi nesteeksi. Tämä haihdutettiin myös happikaasun jäähdyttämiseksi, jotta siitä saatiin nestemäinen. Hän lähetti 22. joulukuuta 1877 Ranskan tiedeakatemialle sähkeen, jossa hän kertoi löydöstään.

Lavoisierin hajoamisilma
Ominaisuudet
Ominaisuudet ja molekyylirakenne
Vakiolämpötilassa ja -paineessa hapella ei ole väriä, hajua tai makua. Se on kaasu, jonka kemiallinen kaava on O
2 jota kutsutaan dioksihapeksi.
Kaksi happiatomia on kemiallisesti sidottu toisiinsa diohappina (tai vain happikaasuna). Tätä sidosta voidaan kutsua moneksi, mutta sitä kutsutaan yksinkertaisesti kovalenttiseksi kaksoissidokseksi. Happikaasu on hyvin reaktiivista ja voi reagoida monien muiden alkuaineiden kanssa. Oksideja syntyy, kun metallien alkuaineet reagoivat hapen kanssa, kuten rautaoksidi, joka tunnetaan nimellä ruoste. Maapallolla on paljon oksidiyhdisteitä.
Allotroopit
Hapen yleinen allotrooppi (tyyppi) maapallolla on dioxygen (O2 ). Se on maapallon ilmakehän toiseksi suurin osa dinitrogeenin (N2 ) jälkeen. O2 sidoksen pituus on 121 pm ja sidosenergia 498 kJ/mol. Energiansa vuoksi O2 on monimutkaisen elämän, kuten eläinten, käyttämä.
Otsoni (O3 ) on erittäin reaktiivinen ja vahingoittaa keuhkoja hengitettynä. Otsonia syntyy yläilmakehässä, kun O2 yhdistyy puhtaan hapen kanssa, joka syntyy, kun O2 jakautuu ultraviolettisäteilyn vaikutuksesta. Otsoni absorboi paljon sähkömagneettisen spektrin UV-osan säteilyä, joten yläilmakehän otsonikerros suojaa maapalloa säteilyltä.
Otsonikerroksen yläpuolella (matalilla Maan kiertoradoilla) atomaarisesta hapesta tulee yleisin muoto.
Tetrahappi (O4 ) löydettiin vuonna 2001. Sitä on olemassa vain äärimmäisissä olosuhteissa, kun O2 -aineeseen kohdistuu suuri paine.
Fysikaaliset ominaisuudet
Happi liukenee ilmasta veteen helpommin kuin typpi. Kun ilmassa ja vedessä on sama määrä ilmaa ja vettä, jokaista kahta typpimolekyyliä kohti on yksi molekyyli O 22 (suhde 1:2). Tämä eroaa ilmasta, jossa hapen ja typen suhde on 1:4. O2 liukenee myös helpommin makeaan veteen kuin meriveteen. Happi tiivistyy 90,20 K:ssa (-182,95 °C, -297,31 °F) ja jäätyy 54,36 K:ssa (-218,79 °C, -361,82 °F). Sekä nestemäinen että kiinteä O2 on läpinäkyvää ja väriltään vaaleansinistä.
Happi on hyvin reaktiivista, ja se on pidettävä kaukana kaikesta, mikä voi palaa.
Isotoopit
Luonnossa on kolme hapen stabiilia isotooppia. Ne ovat16 O,17 O ja18 O. Noin 99,7 prosenttia hapesta on16 O-isotooppia.
Tapahtuma
Happi on maailmankaikkeuden kolmanneksi yleisin alkuaine vedyn ja heliumin jälkeen. Noin 0,9 % Auringon massasta on happea.
| Linnunradan galaksin kymmenen yleisintä alkua spektroskooppisesti arvioituna | ||||
| Z | Elementti | Massaosuus miljoonasosina | ||
| 1 | 739,000 | 71 × hapen massa (punainen palkki) | ||
| 2 | 240,000 | 23 × hapen massa (punainen palkki) | ||
| 8 | Happi | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neon | 1,340 |
| |
Happi on raudan ohella maapallon yleisin alkuaine (massaltaan). Se muodostaa lähes puolet (46-49,2 %) maankuoren massasta osana oksidiyhdisteitä, kuten piidioksidia, ja muita yhdisteitä, kuten karbonaatteja. Happea on myös maapallon valtamerien pääosa, 88,8 % massaltaan. Happikaasu on toiseksi yleisin osa ilmakehää, ja sen osuus on 20,95 % sen tilavuudesta ja 23,1 % sen tilavuudesta. Maa on muihin planeettoihin verrattuna outo, sillä suuri osa sen ilmakehästä on happikaasua. Marsissa on vain 0,1 % O
2 tilavuusprosenttia, ja muilla planeetoilla sitä on vähemmän.
Maapallon ympärillä oleva paljon suurempi happikaasun määrä johtuu hapen kiertokulusta. Fotosynteesi ottaa vedestä vetyä auringonvalon energian avulla. Tällöin syntyy happikaasua. Osa vedystä yhdistyy hiilidioksidin kanssa hiilihydraateiksi. Hengitys ottaa sitten happikaasua ilmakehästä tai vedestä ja muuttaa sen hiilidioksidiksi ja vedeksi.
Käyttää
Lääketieteellinen
O2 on erittäin tärkeä osa hengitystä. Tämän vuoksi sitä käytetään lääketieteessä. Sitä käytetään lisäämään hapen määrää ihmisen veressä, jotta hengitys tehostuisi. Tämä voi nopeuttaa sairastuneen ihmisen tervehtymistä. Happihoitoa käytetään keuhkolaajentuman, keuhkokuumeen, joidenkin sydänongelmien ja kaikkien sellaisten sairauksien hoitoon, jotka vaikeuttavat hapenottoa.
Elintoiminnot
Avaruuspuvuissa käytetään matalapaineista O2 -kaasua, joka ympäröi kehon. Puhdasta happea käytetään, mutta paljon alhaisemmassa paineessa. Jos paine olisi korkeampi, se olisi myrkyllistä.
Teollinen
Rautamalmin sulattaminen teräkseksi kuluttaa noin 55 prosenttia ihmisen tuottamasta hapesta. Tätä varten malmiin ruiskutetaan O2 -kaasua korkeassa paineessa lansetin kautta. Tämä poistaa malmista rikkiä ja hiiltä, joita ei haluta käyttää. Ne poistuvat rikkioksidina ja hiilidioksidina. Lämpötila voi nousta jopa 1 700 °C:seen, koska kyseessä on eksoterminen reaktio.
Kemistit käyttävät noin 25 prosenttia ihmisen tuottamasta hapesta. Etyleeni reagoi O:n kanssa2 ja muodostaa etyleenioksidia. Tämä muuttuu sitten etyleeniglykoliksi, josta valmistetaan monia tuotteita, kuten pakkasnestettä ja polyesteriä (näistä voidaan sitten tehdä muovia ja kankaita).
Loput 20 prosenttia ihmisen tuottamasta hapesta käytetään lääketieteessä, metallien leikkauksessa ja hitsauksessa, rakettipolttoaineena ja vedenkäsittelyssä.

Happikeskitin keuhkolaajentumapotilaan talossa.
Yhdisteet
Hapen hapetusaste on -2 lähes kaikissa yhdisteissä, joissa se esiintyy. Muutamissa yhdisteissä, kuten peroksideissa, hapetusaste on -1. Hapen yhdisteet, joissa happi on muussa hapen hapetusasteessa, ovat hyvin harvinaisia.
Oksidit ja muut epäorgaaniset yhdisteet
Vesi (H
2O) on vedyn oksidi. Se on maapallon yleisin oksidi. Kaikki tunnettu elämä tarvitsee vettä elääkseen. Vesi koostuu kahdesta vetyatomista, jotka ovat kovalenttisesti sitoutuneet happiatomiin (hapella on suurempi elektronegatiivisuus kuin vedyllä). (tämä on kovalenttisen sidoksen perusperiaate) Vetyatomien ja viereisten molekyylien happiatomien välillä on myös sähköstaattisia voimia (Van de'r Waalsin voimia). Nämä pseudosidokset tuovat atomit noin 15 % lähemmäksi toisiaan kuin useimmat muut yksinkertaiset nesteet. Tämä johtuu siitä, että vesi on polaarinen molekyyli (elektronien epäsymmetrinen nettojakauma) sen taivutetun muodon vuoksi, mikä antaa sille kokonaisnettokentän suunnan, joka johtuu pääasiassa häkägeenien kahdesta ei-sitovasta elektroniparista, jotka työntävät sidoksissa olevat H:t kauemmas toisiinsa kuin lineaarinen järjestely, jolla on alhaisempi entalpia (ks. hiilidioksidi2 ). Mikroaallot hyödyntävät tätä ominaisuutta polaaristen molekyylien, erityisesti veden, värähtelyssä. Ja se on vastuussa ylimääräisestä energiasta, jota tarvitaan H:n2 0 disassosiaatioon.
Koska hapella on suuri elektronegatiivisuus, se muodostaa kemiallisia sidoksia lähes kaikkien muiden kemiallisten alkuaineiden kanssa. Näistä sidoksista syntyy oksideja (esimerkiksi rauta reagoi hapen kanssa muodostaen rautaoksidia). Useimmat metallien pinnat muuttuvat oksideiksi, kun ne ovat ilmassa. Raudan pinta muuttuu ruosteeksi (rautaoksidiksi), kun se on pitkään ilmassa. Hiilidioksidia (CO
2) ilmassa, ja se muuttuu hiilihydraateiksi fotosynteesin aikana. Elävät olennot luovuttavat sitä hengityksen aikana.
Orgaaniset yhdisteet
Monissa orgaanisissa yhdisteissä on happea. Happea sisältäviä orgaanisia yhdisteitä ovat esimerkiksi alkoholit, eetterit, ketonit, aldehydit, karboksyylihapot, esterit ja amidit. Myös monissa orgaanisissa liuottimissa on happea, kuten asetonissa, metanolissa ja isopropanolissa. Happea on myös lähes kaikissa elävien olentojen tuottamissa biomolekyyleissä.
Happi reagoi myös nopeasti monien orgaanisten yhdisteiden kanssa huoneenlämmössä tai sen alapuolella, kun tapahtuu autoksidaatiota.
Teollisuustuotanto
Sata miljoonaa tonnia O2 saadaan vuosittain ilmasta teolliseen käyttöön. Teollisuus käyttää kahta päämenetelmää hapen valmistukseen. Yleisin menetelmä on nesteytetyn ilman jakotislaus. N 2haihtuu, kun taas O2 jää nesteeksi. O2 on toiseksi tärkein teollisuuskaasu.Koska se on taloudellisempaa, happi varastoidaan ja kuljetetaan yleensä nesteenä. Pieneen 16 litran vesisäiliöön, jonka käyttöpaine on 139 bar (2015 psi), mahtuu noin 2150 litraa kaasua, ja se painaa tyhjänä 28 kilogrammaa (62 lb). 2150 litraa happea painaa noin 3 kilogrammaa (6,6 lb).
Toinen päämenetelmä hapen valmistamiseksi on puhtaan, kuivan ilmavirran johtaminen zeoliittipari-molekyyliseulojen läpi. Zeoliitin molekyyliseulat imevät typpeä. Näin saadaan kaasuvirta, joka sisältää 90-93 prosenttia happea.
Happikaasua voidaan valmistaa myös veden elektrolyysillä molekyyliseksi hapeksi ja vedyksi.

Oikeanpuoleisessa pullossa on nestemäistä happea.
Turvallisuus
Hapen NFPA 704:n mukaan paineistettu happikaasu ei ole terveydelle vaarallista eikä syttyvää.
Myrkyllisyys
Korkeissa paineissa happikaasu (O2 ) voi olla vaarallista eläimille, myös ihmisille. Se voi aiheuttaa kouristuksia ja muita terveysongelmia. Hapen myrkyllisyys alkaa yleensä ilmetä yli 50 kilopascalin (kPa) paineessa, joka vastaa noin 50 %:n happipitoisuutta ilmassa normaalipaineessa (maapallon ilmassa on noin 20 % happea).
Ennen vanhaan ennenaikaiset vauvat laitettiin laatikoihin, joissa oli runsaasti O:ta sisältävää ilmaa2 . Tämä lopetettiin, kun jotkut vauvat sokeutuivat hapen vaikutuksesta.
Puhtaan O:n hengittäminen2 avaruuspuvuissa ei aiheuta vahinkoa, koska paine on pienempi.
Palamisvaarat ja muut vaarat
Tiivistetyt määrät puhdasta O2 voivat aiheuttaa nopean tulipalon. Kun väkevä happi ja polttoaineet tuodaan lähelle toisiaan, pienikin syttyminen voi aiheuttaa valtavan tulipalon. Apollo 1:n miehistö kuoli tulipalossa, koska kapselin ilmassa oli erittäin paljon happea.
Jos nestemäistä happea valuu orgaanisten yhdisteiden, kuten puun, päälle, se voi räjähtää.
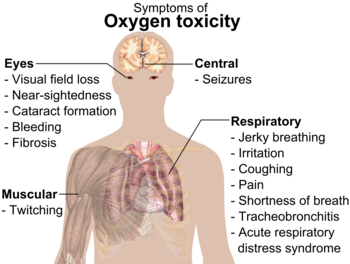
Happimyrkytyksen oireet.
Aiheeseen liittyvät sivut
Kysymyksiä ja vastauksia
K: Mikä on hapen symboli?
V: Hapen symboli on O.
K: Kuinka monta happiatomia on yleensä diohapessa (O2)?
V: Diohapessa (O2) on yleensä kaksi happiatomia.
K: Minkä värinen on nestemäinen tai kiinteä happi?
V: Nestemäinen tai kiinteä happi on väriltään vaaleansinistä.
K: Mihin jaksollisen järjestelmän ryhmään happi kuuluu?
V: Happi kuuluu jaksollisen järjestelmän kalkogeeniryhmään.
K: Kuinka suuri osa maapallon ilmakehän tilavuudesta koostuu hapesta?
V: Happi muodostaa yli viidenneksen maapallon ilmakehän tilavuudesta.
K: Miten kasvit ja muut eliöt tuottavat suurimman osan maapallon ilmakehän hapesta?
V: Kasvit ja muut eliöt tuottavat suurimman osan maapallon ilmakehän hapesta fotosynteesillä, jossa auringonvaloa käytetään veden muuttamiseen vedyksi ja sivutuotteena vapautuu happea.
K: Mihin tarkoituksiin nestemäistä tai jähmettynyttä happea käytetään?
V: Nestemäistä tai jähmettynyttä happea voidaan käyttää rakettien polttoaineena, hitsaukseen, lääketieteellisiin tarkoituksiin ja hengittämiseen silloin, kun hyvää ilmaa ei ole saatavilla (esim. sukeltajat ja palomiehet).
Etsiä