Alkyynit (CnH2n-2) – määritelmä, rakenne, ominaisuudet ja reaktiot
Alkyynit (CnH2n-2) — selkeä määritelmä, rakenne, fysikaaliset ominaisuudet ja tärkeimmät reaktiot: pelkistys, additio, deprotonointi ja synteesikäytännöt.
Alkyyni on molekyyli, jossa kahden hiiliatomin välillä on kolmoissidos. Niiden yleinen kaava on CnH2n-2. Alkyyneja kutsutaan myös asetyleeneiksi. Pienin, yksinkertaisin alkyyni on asetyleeni (etyyni). Alkyynit ovat pääsääntöisesti hydrofobisia: ne liukenevat hyvin orgaanisiin liuottimiin mutta eivät juuri veteen. Sarjan peräkkäinen jäsen eroaa yleensä molekyylirakenteeltaan yhdellä -CH2--ryhmällä.
Rakenne ja sidokset
Alkyynien kolmoissidos muodostuu yhdestä σ-sidoksesta ja kahdesta π-sidoksesta. Kolmoissidoksen ympärillä oleva hiiliketju on suora, eli sidoksen ympärillä oleva kulma on 180° (lineaarinen muoto). Kolmoissidoksen sitoutuminen syntyy sp-hybridisaation kautta: molemmilla triple-bond-hiilillä on kaksi sp-atomiorbitaalia ja kaksi epähybridisoitunutta p-orbitaalia, jotka muodostavat π-sidokset. Kolmoissidokset ovat voimakkaampia ja lyhyempiä kuin kaksois- tai yksinkertaiset sidokset.
Kemialliset ominaisuudet ja reaktiot
Alkyynit ovat yleensä reaktiivisempia kuin vastaavat alkeenit monissa additioreaktioissa, mutta reaktiivisuus riippuu reaktion tyypistä. Terminaliset alkyynit (kolmoissidos ketjun päässä) ovat hieman happamampia kuin alkeenit ja alkaanit: protonuiminen hiili voidaan deprotonisoida vahvalla emäksellä, jolloin muodostuu asetylidianiioni. Tämän vuoksi protonin poistaminen vahvalla emäksellä on tapa tehdä nukleofiilinen hiili, jota voidaan käyttää esimerkiksi liittämiseen hiili-hiili -syntetisoissa tai additioreaktioissa.
- Pelkistys: Alkyyneja voidaan pelkistää ensin kaksoissidoksiksi ja edelleen yksinkertaisiksi sidoksiksi. Osittainen katalyyttinen hydrogenaatio (esim. Lindlarin katalysaattori) tuottaa cis-alkeenin; liuottimet ja metallinen ammoinen pelkistys (esim. Na/NH3) voivat antaa trans-alkeenin.
- Additioreaktiot: alkyynit osallistuvat halogeno-, hydrohalogeeni- ja hydroksylaatioreaktioihin. Esimerkiksi hydrohalogenaatiolla saadaan halogenoalkeenia tai -alkaania (Markovnikovin sääntöä noudattaen), ja hydraatiolla terminalisesta alkyynista muodostuu yleensä ketoni (enoli tautomerisoituu ketoniksi).
- Hydroborointi-oksidaatio: anti-Markovnikov-tyyppinen hydroborointi-oksidaatio voi johtaa aldehydin muodostumiseen terminalisesta alkyynista (erityisolosuhteet vaaditaan).
- Substituutio päätteisissä alkyyneissä: deprotonoiduista terminalisista alkyyneistä (asetylidit) voidaan muodostaa C–C-sidoksia reagoimalla halogenoalkaanien tai karbonyyliyhdisteiden kanssa (esim. lisäys ketoniin).
- Perusykliset ja perisykliset reaktiot: alkyynit osallistuvat erilaisiin sykloadditioihin ja perisyklisiin reaktioihin, mm. [2+2+2]-trimerisaatioihin ja 1,3-dipolaarisiin cycloadditioihin (esim. Huisgenin 1,3-dipolaarinen silmukkareaktio, jota hyödynnetään "click chemistryssä"). Näistä on runsaasti sovelluksia synteettisessä kemiassa ja materiaalitutkimuksessa.
Fyysiset ominaisuudet ja käyttö
Alkyynit ovat yleensä värittömiä, helposti syttyviä ja lievästi aromaattisia nesteitä tai kaasuja riippuen hiilimäärästä. Kuten muidenkin hiilivetyjen kohdalla, kiehumispiste ja sulamispiste kasvavat molekyylipainon kasvaessa. Terminaliset alkyynit ovat lievästi happamia (pKa noin 25), mikä selittää niiden kyvyn muodostaa asetylidioneja vahvoilla emäksillä.
Turvallisuus ja säilytys
Pienet alkyynit, erityisesti asetyleeni, voivat olla räjähdysvaarallisia tietyissä olosuhteissa (esimerkiksi paineen tai tietyntyyppisten metallien kuten kuparin läsnä ollessa). Siksi kaasujen ja liuosten käsittelyssä on noudatettava asianmukaisia turvallisuusohjeita. Käytännön laboratoriokäytössä ja teollisuudessa käytetään sopivia säiliöitä, paineensäädintöjä ja inerta-olosuhteita, jotta vältytään vaaroilta.
Yhteenvetona: alkyynit (CnH2n-2) ovat lineaarisia, sp-hybridisoituneita hiilivetyjä, joiden kolmoissidos antaa niille erityisiä kemiallisia ominaisuuksia ja tekee niistä hyödyllisiä rakennuspalikoita orgaanisessa synteesissä.
Rakenne
Alkyyneillä on 180 asteen kulma kahden hiiliatomin välillä. Tästä syystä ne eivät halua olla syklisessä yhdisteessä. Alla on esitetty joitakin esimerkkejä alkyyneistä.
| Toiminnalliset ryhmät |
|
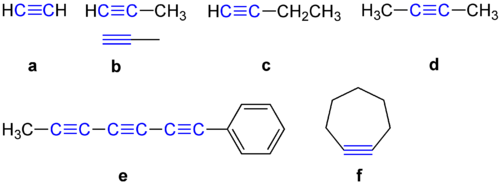
Esimerkkejä alkyyneistä
Kysymyksiä ja vastauksia
Q: Mikä on alkiini?
A: Alkiini on molekyyli, jossa kahden hiiliatomin välillä on kolmoissidos.
K: Mikä on alkyynien yleiskaava?
V: Alkyynien yleiskaava on CnH2n-2.
K: Mikä on pienin alkydi?
V: Pienin alkydi on asetyleeni, jota kutsutaan myös etyyniksi.
K: Ovatko alkyynit hydrofobisia vai hydrofiilisiä?
V: Alkyynit ovat hydrofobisia eli ne liukenevat hyvin orgaanisiin liuottimiin mutta eivät veteen.
K: Miten alkyynin peräkkäiset jäsenet eroavat toisistaan?
V: Alkynin jokainen peräkkäinen jäsen eroaa molekyylirakenteeltaan "-CH2".
K: Ovatko alkyynit reaktiivisempia kuin tavalliset hiilivedyt?
V: Kyllä, alkyynit ovat monissa reaktioissa reaktiivisempia kuin tavalliset hiilivedyt, kuten alkeenit.
K: Mitä alkynilla voidaan tehdä molekyylin lopussa?
V: Jos alkydi on molekyylin lopussa, se voidaan helposti poistaa protonoimalla se vahvalla emäksellä ja käyttää sitten additioreaktioissa, kuten lisäämällä se ketoniin.
Etsiä